动脉粥样硬化(atherosclerosis, AS)是心血管疾病的主要始动因素,其中易损斑块的形成容易导致心肌梗死、中风甚至猝死等致命事件。目前,临床上检测动脉硬化斑块的方法主要包括影像学和血液检测,但这些方法敏感性和特异性较低,难以实现AS的早期检测及其病理进程的动态监测。细胞外囊泡(extracellular vesicles, EVs)是细胞分泌的磷脂双分子层囊性小泡,存在于各种体液中,其携带特定的核酸、蛋白质和小分子代谢产物,被认为是下一代疾病标志物。然而,疾病组织来源的EVs在体液中丰度较低,相关标志物的鉴定仍处于起步阶段,且检测困难。
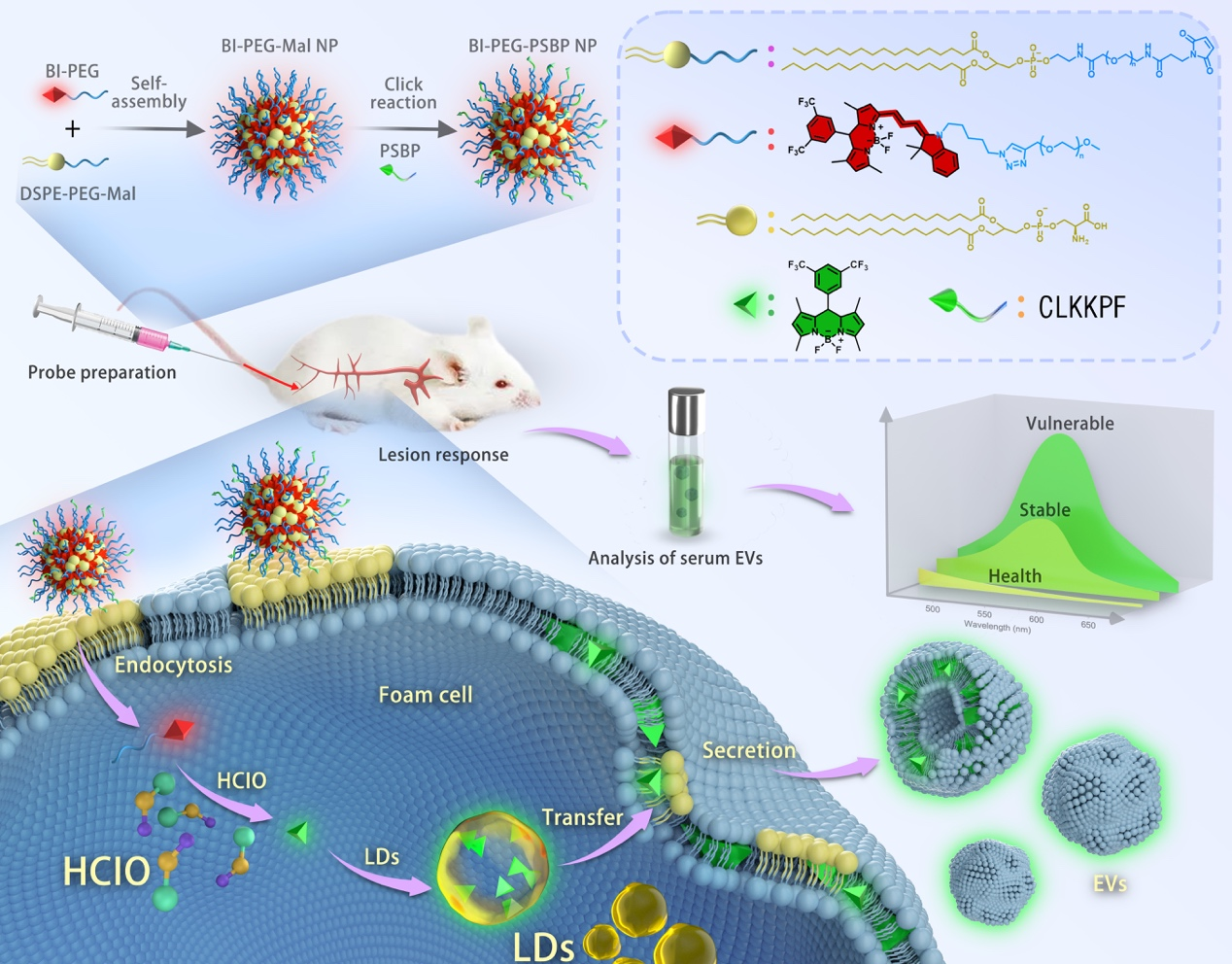
南开大学化学学院刘定斌教授课题组近期在美国化学会旗舰期刊Journal of the American Chemical Society上发表题为“In Vivo Fluorescent Labeling of Foam Cell-Derived Extracellular Vesicles as Circulating Biomarkers for In Vitro Detection of Atherosclerosis”的研究论文(doi: 10.1021/jacs.4c01173),开发了一种名为BI–PEG-PSBP NPs的荧光探针,可以在活体水平特异性地标记泡沫细胞及其分泌的EVs,通过检测外周血中荧光标记的EVs,实现对AS斑块形成的早期检测和斑块易损性的准确鉴别,为心血管疾病的有效管理提供了一种新思路和液体活检技术。
该团队的前期研究表明,在巨噬细胞泡沫化的过程中,活性氧物种(如HClO)和脂滴(lipid droplets, LDs)的上调被认为是泡沫细胞的典型特征(Angew. Chem. Int. Ed. 2022, 61, e202204518)。据此,研究人员设计了一种可依次被HClO和LDs激活的比率荧光探针。通过合理的设计和化学合成,研究人员得到了BI-PEG-PSBP NPs。与绝大多数泡沫细胞探针不同的是,BI-PEG-PSBP NPs具有良好的亲水性,这一特性极大地增强了其在生物体内的循环能力,降低了网状内皮系统对其非特异性识别和清除的几率,并通过其表面修饰的凋亡泡沫细胞靶向肽PSBP进一步提高了其对AS斑块的识别能力。BI-PEG-PSBP NPs在进入泡沫细胞后,迅速被HClO降解为亲脂性分子B-CF3,吸附到LDs表面,发射波长从740 nm 变为540 nm。荧光脂滴在泡沫细胞内进行多级代谢和循环,将其所携带的B-CF3递送到细胞膜中,并随着EVs的分泌过程而转移到EVs膜中,从而形成荧光标记的EVs。该荧光标记的EVs亮度高,可通过常规的荧光光度计或酶标仪即可实现快速检测,具有良好的临床应用潜力。
参考文献:
In Vivo Fluorescent Labeling of Foam Cell-Derived Extracellular Vesicles as Circulating Biomarkers for In Vitro Detection of Atherosclerosis, J Am Chem Soc.2024 Mar 28. doi: 10.1021/jacs.4c01173.





