2024年3月18日,河南科技大学基础医学与法医学院梁高峰教授团队在International Journal of Nanomedicine发表了题为“Emerging Strategies to Overcome Current CAR-T Therapy Dilemmas - Exosomes Derived from CAR-T Cells”的综述 (2024:19 Pages 2773—2791),此文介绍了基于CAR-T细胞的肿瘤治疗方法,包括CAR-T疗法的特点和优点,该领域存在的局限性,以及克服这些局限性的措施。此外,讨论了利用CAR-T细胞释放的外泌体在肿瘤治疗中的显著益处。最后,根据以往对CAR-T细胞外泌体的研究和外泌体的特点,我们提出了克服这些限制的策略。此外,还讨论了外泌体大规模制备的困境,并为未来的临床应用提供了可能的解决方案。
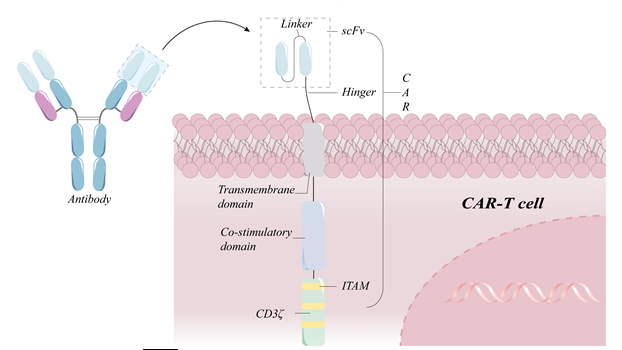
过继性T细胞免疫疗法,特别是嵌合抗原受体T细胞(CAR-T),在血液系统恶性肿瘤的治疗中显示出良好的疗效。美国食品和药物管理局(FDA)已经批准了6种针对血液肿瘤的CAR-T相关产品的商业化肿瘤靶抗原与细胞外结合域特异性抗体的单链可变片段(single-chain variable fragment, scFv)紧密结合后,信号通过铰区即跨膜结构域传递到细胞内结构域,随后在T细胞内启动活化。值得注意的是,细胞内信号域是T细胞激活的初始信号,而细胞内共刺激域如CD28/4-1BB是T细胞持续激活和增殖不可或缺的部分(图1)。但随着对CAR-T疗法的深入研究,细胞因子释放综合征(CRS)、CAR-T细胞耗竭、实体瘤浸润困难、肿瘤复发等挑战严重阻碍了CAR-T疗法的临床应用。
随着研究的进行发现,免疫逃逸、CAR与靶抗原识别能力下调与CAR-T细胞的衰竭等因素是造成肿瘤复发的重要因素,值得一提的是,免疫逃逸是造成患者发生肿瘤复发的关键与潜在因素,这与肿瘤细胞自身的靶抗原发生剪接异常与基因突变密切相关。除此之外,细胞因子风暴也严重制约着CAR-T疗法治疗肿瘤患者的更大规模临床引用的重大因素。当前已经开发出了许多的方法试图缓解上述的困境,例如开发出多靶点CAR、微调CAR结构、调节亲和力与人工覆盖靶抗原等方法。但是这些并未从根源上缓解CAR-T疗法在实体瘤应用的困境。
一种新的基于外泌体的策略已经被开发出来,以解决当前CAR-T疗法临床应用中遇到的挑战。该策略在临床前模型中成功展示了显著的抗肿瘤作用,目前正在考虑进行临床试验。外泌体由圆形双膜脂质层和囊泡内容物组成,它不但能排除胞内的代谢废物还是细胞间通讯的重要媒介。有趣的是,外泌体能在恶劣的肿瘤微环境保持活性还具备来源细胞的生物功能,例如来自免疫细胞的外泌体也获得了原细胞的特性,这使得使用免疫细胞释放的外泌体来治疗具有治疗效果的肿瘤,如NK细胞、T细胞和CAR-T细胞具有刺激作用。那么,来自CAR-T细胞的外泌体也继承了CAR-T细胞杀伤性与靶向性,不仅如此由于外泌体纳米级别的颗粒这使得来自CAR-T细胞的外泌体能够有效浸润实体瘤的内部以实现对实体瘤的有效杀伤能力,这表明了利用来自CAR-T细胞的外泌体治疗实体瘤具备的潜力。
外泌体运输的货物的状态和组成与起源细胞密切相关,起源细胞也运输来自母细胞的货物,如miRNA、信使RNA、长链非编码RNA和蛋白。来源于免疫细胞的外泌体在对抗肿瘤(如树突状细胞(DC)、自然杀伤细胞(NK)、T细胞以及CAR-T细胞)方面显示出优异的效果。CAR-T细胞外泌体在肿瘤治疗中具有广阔的临床应用前景。这些外显子体含有CAR-T细胞的关键成分,包括靶向肿瘤细胞的CAR、颗粒酶和穿孔素,它们有助于杀死肿瘤细胞(图2)。因此,外泌体具有CAR-T细胞的一些肿瘤杀伤能力。有研究发现,CAR-T细胞在受到肿瘤细胞的刺激时,可以释放更多的外泌体。这些外泌体表现出更强的与肿瘤结合的能力并发挥抗肿瘤作用。此外,CAR-NK细胞衍生的外泌体也有报道显示出CAR-NK细胞特异性杀伤活性,显示出特殊的抗肿瘤作用。这一发现表明,利用基于CAR的免疫细胞(如CAR- T、CAR-NK、CAR- M)衍生的外泌体是推动CAR疗法走向临床应用的关键一步。
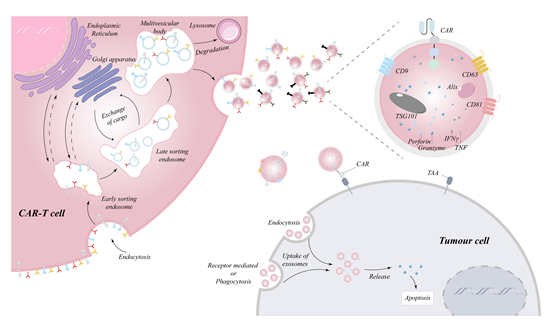
除此之外,外泌体与活的CAR-T细胞不同,外泌体不会以相同的方式对周围环境做出反应,这使得它们能够有效地避免CRS的发生,并且不受肿瘤免疫抑制微环境的影响。有趣的是,外泌体本身是优秀的纳米级药物载体,不仅在体内具有相容性和安全性,而且还被证明可以携带额外的化疗药物以增强抗肿瘤效果。外泌体携带治疗药物和miRNA或siRNA,使其不仅能靶向浅表肿瘤细胞,还能靶向深部肿瘤细胞,有效杀伤肿瘤。CAR-T细胞外泌体除了装载外,还在脉管系统和肿瘤微环境中表现出持续的活力,这表明工程化CAR-T外泌体策略的发展可能会进一步完善这种治疗方法,以实现治愈肿瘤的目标。此外此文章利用外泌体的装载性还展望了利用U1小核RNA(SnRNA)以纠正来纠正剪接异常,并利用外显子特异性的U1SnRNA (ExSpeU1),能够纠正导致外显子跳变的不同类型的突变,这可能为解决未来的医疗姑息靶向问题提供一种新的思路。此产生的工程外泌体可以克服由于剪接异常导致的靶抗原丢失的挑战,这无疑从根本上提高了抗肿瘤的有效性和持久性。此外,基因编辑是一种可以在基因组水平上修改DNA序列的基因操作技术,目前在实验中用于治疗神经系统疾病(最著名的是阿尔茨海默病),在未来的临床应用中是可行的,但在临床应用之前必须解决许多问题。这种方法仍然面临着许多问题,包括融合酶不可忽视的免疫原性和递送障碍,必须克服这些问题才能有效地在临床应用。幸运的是,许多将CRISPR/ Cas9样基因编辑技术装入外泌体以解决运输和免疫原性问题的报道已经发表,越来越多的证据表明,外泌体可以用作基因编辑药物和靶向癌症的有效递送载体。基因编辑技术与外泌体的“有机结合”是高度可行的,将携带的RNA序列替换为CAR蛋白靶向导致肿瘤超载引起突变前的RNA序列,从而完成突变引起的抗原逃逸的根本纠正,让融合酶充当“检查者”。一旦肿瘤细胞由于CAR靶向压力而发生突变,融合酶就会在遗传水平上发挥纠正功能,迫使肿瘤细胞恢复到突变前的蛋白状态,从而使CAR-T细胞释放的外泌体能够继续靶向肿瘤细胞,从而降低肿瘤复发的可能性,提高治愈率。这些工程策略将进一步缓解外泌体在治疗肿瘤方面的局限性,并加速其在临床患者中的转化应用。
综上所述,来自CAR-T细胞的外泌体被认为是克服CAR-T治疗障碍的最有希望的解决方案。外泌体的负载特性允许进一步改进治疗特性,并且它们也可以继承CAR,从而有可能在临床试验中使用CAR-T细胞衍生的外泌体。为了解决与CAR和肿瘤抗原靶向相关的挑战,研究人员提出了外泌体结合的创新方法。将融合酶装载到外泌体中,调节异常剪接的激酶,以及遗传可能在该领域开发的新型CAR都是治疗肿瘤的可能策略。另外,通过自上而下的策略制备外泌体可以显著降低成本,使其成为更经济合理的解决方案。尽管未来CAR-T细胞外泌体在肿瘤治疗领域越来越显示出巨大的应用潜力,但大规模、均匀、稳定、多组分、可控的外泌体制备仍是亟待解决的问题。
外泌体资讯网 Int J Nanomedicine |河南科技大学梁高峰:克服当前CAR-T治疗困境的新兴策略——来源于CAR-T细胞的外泌体





