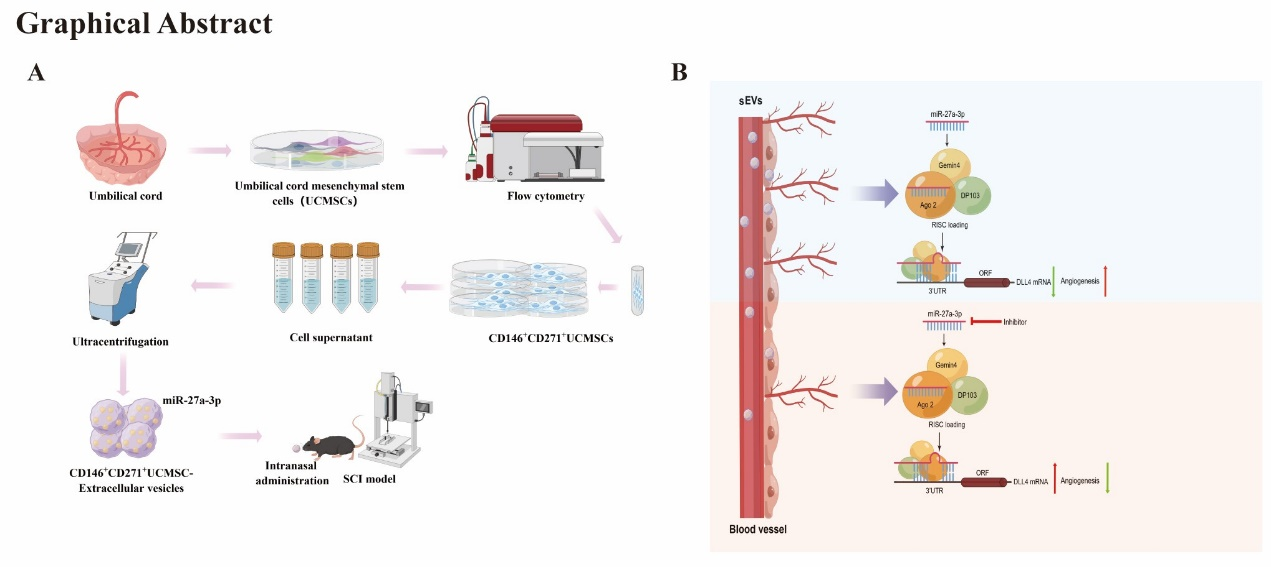
脊髓损伤(SCI)是一种影响运动和感觉功能的严重创伤性疾病。在原发性脊髓损伤过程中,直接外力会导致脊髓实质和神经血管单元结构的破坏,以及神经元和神经胶质细胞的丢失。其中,血管损伤被认为是继发性SCI的主要原因,进一步破坏神经血管单位,并诱导免疫炎症反应,从而形成不利于神经再生的微环境。组织再生和修复依赖于血管再生,血管再生为神经修复提供必要的支架和营养。因此,靶向血管生成可以为SCI后功能恢复提供一种有效的策略。近日,中南大学湘雅医院胡建中、吕红斌课题组在J Control Release上发表题为“Intranasal delivery of small extracellular vesicles from specific subpopulation of mesenchymal stem cells mitigates traumatic spinal cord injury”的原创性文章(2024 Apr 3:369:335-350)。中南大学湘雅医院脊柱外科孙一、赵晋云博士为第一作者,胡建中教授、吕红斌教授为通讯作者。
间充质干细胞(MSCs)源自多种组织,其中脐带间充质干细胞(UCMSCs)因易于获得而成为理想的干细胞治疗来源。然而,UCMSCs的异质性可能限制其临床试验治疗效果。因此,标准化MSCs亚群和鉴定特定MSCs亚群是推动干细胞治疗进步的关键。最新研究表明,CD146+干细胞亚群可治疗肌萎缩,并通过促进血管生成促进损伤组织的恢复。同样,CD271+干细胞亚群表现出包括ANGPT1、ANGPT2和VEGFA等促血管生成基因的高水平表达。这些研究提示,CD146+亚群和CD271+MSCs亚群均具有促进血管生成的良好潜力,并为血管相关疾病的治疗提供新的可能。小细胞外囊泡(sEVs)是一种纳米级囊泡,含有多种生物学活性物质。MSCs来源的sEVs具有与MSCs相似的功能,且避免了干细胞移植的弊端,同时能有效促进组织再生。目前,尚未有研究探索CD146+CD271+UCMSCs亚群的促血管生成作用,并评估其衍生的sEVs在治疗SCI中的作用及其可能的分子机制。在本研究中,我们首先通过流式分选获得CD146+CD271+UCMSCs亚群,并提取其sEVs。继而通过鼻内递送CD146+CD271+UCMSC-sEVs,发现CD146+CD271+UCMSC-sEVs能有效促进SCI后小鼠血管生成和运动功能恢复。进而,我们通过microRNA 阵列分析对CD146+CD271+UCMSC-sEVs的microRNAs进行鉴定,发现多种microRNA的显著富集。其中,miR-27a-3p是介导CD146+CD271+UCMSC-sEVs发挥促血管生成功能的关键分子。进一步机制研究发现,来源于CD146+CD271+UCMSC-sEVs的miR-27a-3p通过抑制Delta Like Canonical Notch Ligand 4 (DLL4)的表达,在体外增强bEnd.3细胞的迁移和成管形成,同时在体内调控血管生成。总之,这项研究结果证实,CD146+CD271+UCMSC-sEVs通过miR-27a-3p/DLL4轴调控血管生成,鼻内递送CD146+CD271+UCMSC-sEVs可作为治疗SCI的一种富有前景的方式。据悉,胡建中、吕红斌教授作为国内在脊髓损伤研究领域的权威专家,已在外泌体治疗脊髓损伤方面取得了一系列成果。研究成果不仅在《ACS Nano》、《BioactiveMaterials》、《Journal of Control Release》等国际顶级期刊上发表,也为脊髓损伤的无细胞治疗奠定了坚实的科学基础。Intranasal delivery of small extracellular vesicles from specific subpopulation of mesenchymal stem cells mitigates traumatic spinal cord injury, J Control Release. 2024 Apr 3:369:335-350. doi: 10.1016/j.jconrel.2024.03.037.外泌体资讯网 J Control Release |湘雅医院胡建中/吕红斌:鼻内递送来自特定间充质干细胞亚群的小细胞外囊泡可减轻创伤性脊髓损伤