创伤、感染和骨肿瘤切除导致的大段骨缺损再生能力有限,严重影响患者的生活质量。因此,对于大段骨缺损的修复需求广泛。目前,用于大段骨修复的原位仿生支架植入在再生医学领域广泛应用。然而,由于缺乏适当的早期微环境调节能力,利用原位骨仿生支架修复大段骨缺损尚未取得重大临床突破。因此,需要进一步研究和发展具有微环境调节功能的修复方法,以提高大段骨缺损再生的效率和成功率。
近日,华中科技大学同济医学院附属协和医院孙家明教授/陈雳风博士团队在国际权威期刊Biomaterials(2022 IF:14.0)上发表了题为“Synergistic large segmental bone repair by 3D printed bionic scaffolds and engineered ADSC nanovesicles: Towards an optimized regenerative microenvironment”的研究论文(DOI:10.1016/j.biomaterials.2024.122566)。该研究发现,通过生物素-链霉亲和素系统将脂肪干细胞来源的工程化纳米囊泡(ADSC-ENs)稳定地负载到仿生骨支架表面,该支架为骨缺损区提供了具有适当活性成分的仿生结构支撑,有效地人工构建了缺损区的局部血管化和成骨微环境,显著促进了血管生成和成骨过程。
为了获得高产量的工程化纳米囊泡(ENs),作者团队采用机械挤压的方法,分别使用10μm、5μm和1μm孔径的膜连续挤压ADSCs。扫描电子显微镜(SEM)显示ENs的形态为椭圆形(图1A)。纳米颗粒跟踪分析(NTA)进一步证明,ENs的尺寸在50-150 nm之间,最大峰位于62±1.5 nm,颗粒数量占总颗粒的86.35%(n=3)(图1B)。蛋白质定量显示,1×107ADSC获得的ENs蛋白质浓度可达88.35±6.62μg/mL,而同等数量ADSC获得的细胞外囊泡(EVs)的蛋白质浓度仅为2.85±1.04μg/mL(n=3)(图1C)。对EVs、ENs和细胞的考马斯亮蓝分析表明,ENs和细胞的蛋白质浓度具有非常相似的SDS-PAGE图谱,而EVs的SDS-PAGE图谱则完全不同(图1E)。其次,将生物素功能化的1,2-dioleoyl-sn-glycero-3-phosphoethanolaminepoly(乙二醇基)(DSPE-聚乙二醇)(DSPE-聚乙二醇-生物素)用于机械挤出改性ENs。用FITC标记的链霉亲和素对ENs的修饰结果进行了评估,荧光显微镜图像显示生物素成功地修饰到ENs上(图1D)。
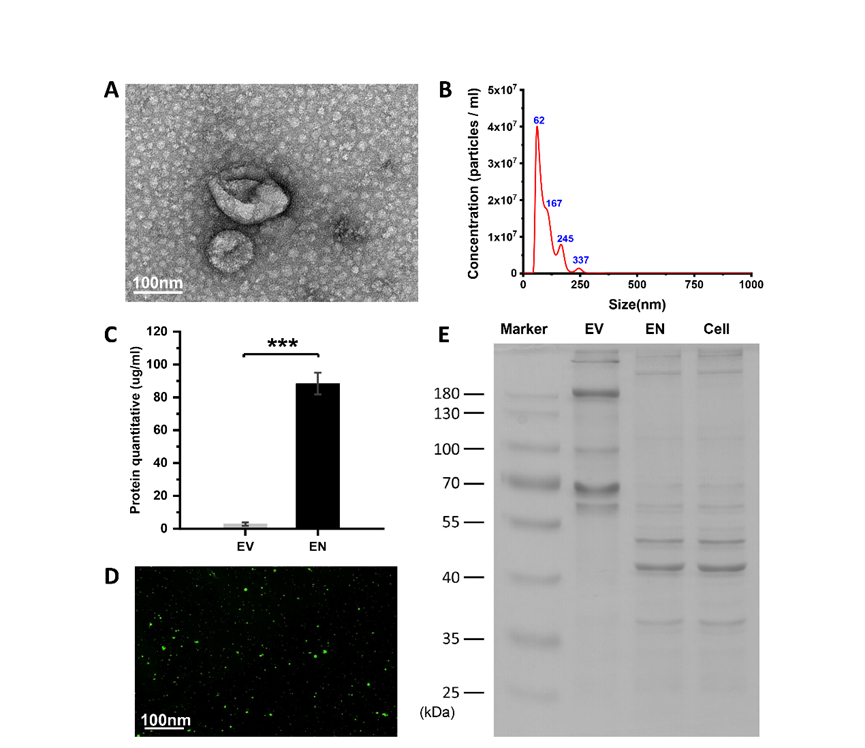
图1 工程化纳米囊泡的生表征与生物素化
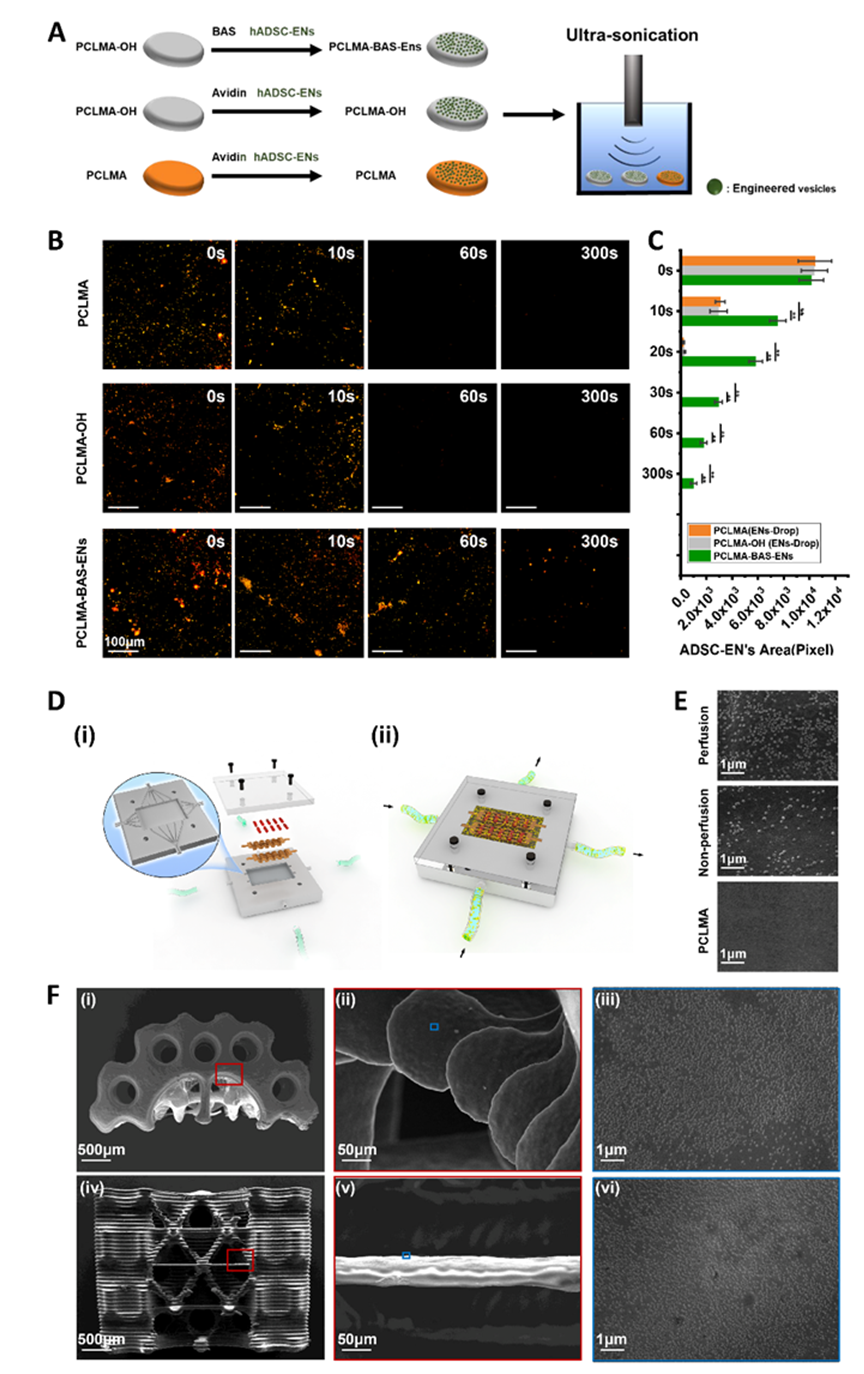
为了验证支架在体外的接枝稳定性,在链霉亲和素存在的情况下,将生物素化的 ADSC-ENs 与生物素化的 PCLMA、PCLMA-OH 和纯 PCLMA 共同培养,然后用超声波清洗器进行超声处理,以测试其机械稳定性(图 2A)。荧光图像显示,随着超声处理时间的延长,ADSC-ENs 的保留率逐渐下降。超声处理 60 秒后,可在生物素化 PCLMA 上清晰地检测到红色荧光标记的 ADSC-EN;相比之下,PCLMA-OH 或 PCLMA 上几乎没有荧光区域(图 2B)。更具体地说,60 秒时 PCLMA-BAS-ENs、PCLMA-OH 和 PCLMA 的荧光面积(像素)分别为 1784.80 ± 259.24、10.00 ± 3.74 和 9.80 ± 3.81(图 2C)。为了改善复杂结构支架中的囊泡负载,作者设计了一种具有不同灌注方向的灌注系统,用于在仿生支架上进行ENs的接枝,该系统由一个灌注室、两个数字控制蠕动泵和两个介质容器组成。设计的灌注室由两部分组成:灌注部分和顶部(图 2D)。前者由白色感光树脂制成,用于容纳灌注支架,后者由半透明树脂制成,用于实时观察。灌注部分的中央最多可放置两根支撑杆,用于固定多个仿生支架。此外,腔体内还有四个固定钉,用于在打印前分别固定顶部和灌注部分。值得注意的是,灌注部分包含用于与介质灌注系统建立连接的孔口,宏观上分为相互垂直的两个方向,所有孔口的直径均为 2 毫米。为了确定复杂结构支架中负载的 ENs 的稳定性,使用了超声波清洗器。扫描电子显微镜图像证实,超声处理 30 秒后,灌注接枝组表面的ENs数量明显高于未灌注接枝组,而未接枝组表面几乎没有ENs残留(图 2E),作者推断灌注装置显著提高了ENs在支架表面的接枝效率。灌注接枝组支架不同部位的扫描电子显微镜图像显示,ENs 在支架表面的所有部位都实现了均匀高效的负载,甚至在支架骨髓腔内复杂结构的表面也是如此(图 2F)。
图2 ENs在材料表面的稳定接枝
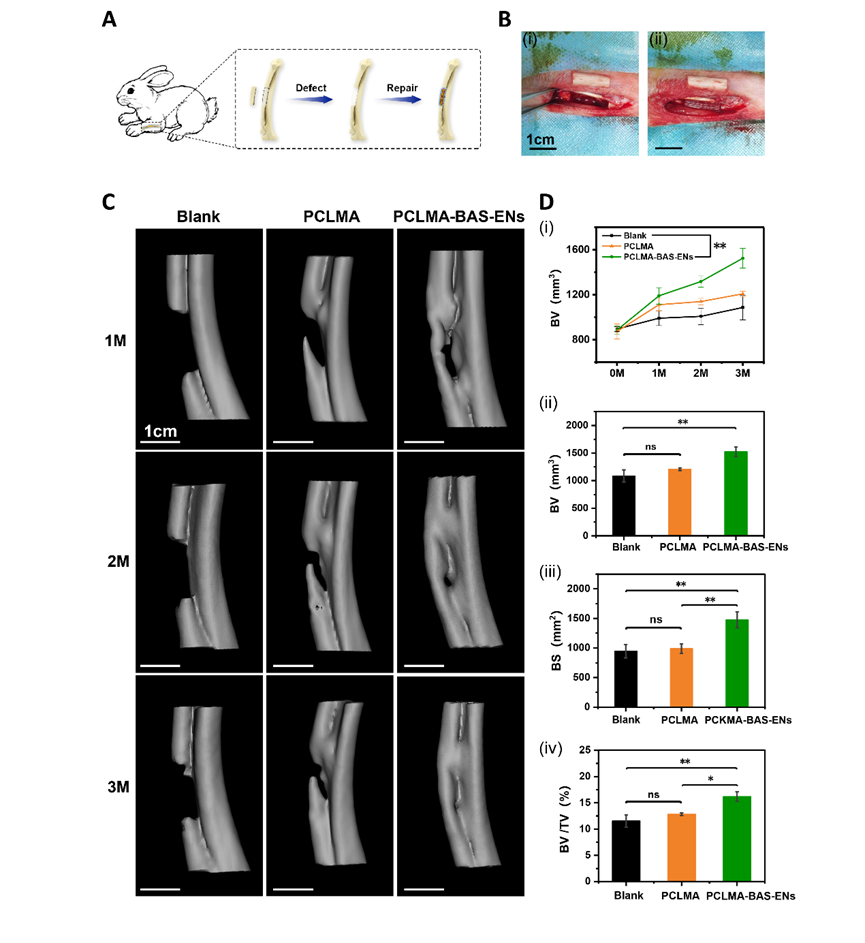
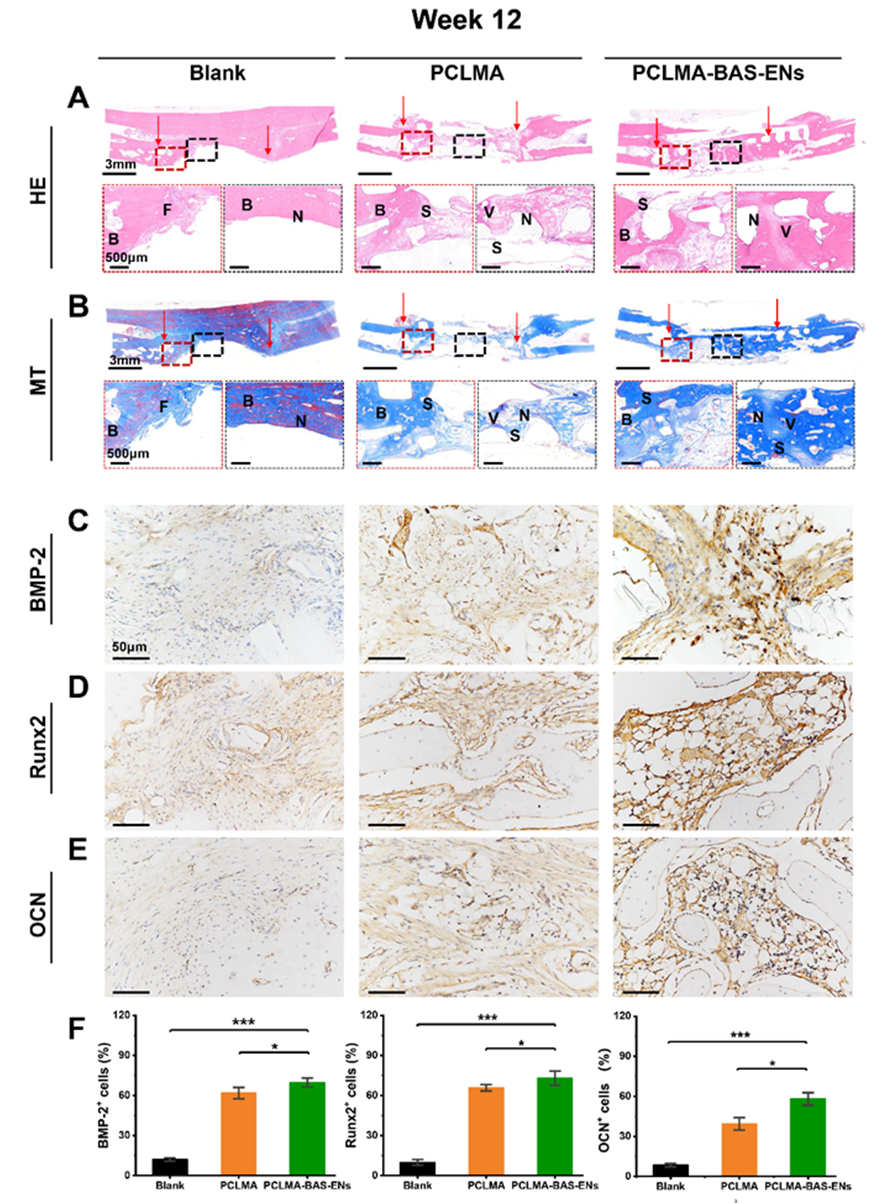
为了进一步验证该策略在临床应用中的潜力,作者采用了兔桡骨原位骨形成试验来分析两种支架的成骨能力(图 3A-B),并用生物素-链霉亲和素法负载 ENs 的 PCLMA 支架(PCLMA-BAS-ENs 组)和纯 PCLMA 支架(PCLMA 组)修复兔桡骨的大段骨缺损(15 mm 长)。第 1、2 和 3 个月的活体 CT 成像显示,三组兔子的骨缺损修复状况存在显著差异,PCLMA-BAS-ENs 组的大部分骨缺损在第 3 个月时已经修复,缺损区域两侧的骨结合更完整、更连续,运动和活动功能恢复正常。第 1、2 和 3 个月的活体 CT 成像显示,三组兔子的骨缺损修复状况存在显著差异。到第三个月时,PCLMA-BAS-ENs 组的大部分骨缺损已经修复,缺损区两侧的骨结合相对完整,运动和活动功能恢复正常。PCLMA 组仅有一小部分骨组织得到修复,但仍明显缺乏骨再生。正如预期的那样,未经处理的空白组几乎没有修复的迹象(图 3C)。值得注意的是,定量分析确定PCLMA-BAS-ENs组的大多数定量指标均高于 PCLMA 组和空白对照组,这表明负载 ENs 的仿生支架所创造的诱导骨微环境在骨再生中发挥了重要作用(图 3D)。与上述检查结果一致,12 周时的组织学染色显示,PCLMA-BAS-ENs组整个骨缺损区域的骨形成相对完整,有大片可见的未成熟胶原纤维(蓝色区域)。在 PCLMA 组中,缺损区中央区域可见明显的骨再生和纤维组织形成,以及不连续的骨结合。在未经处理的空白组中,缺损区中央区域有明显的组织缺失区域(图 4A-B)。尤其是术后 12 周时,PCLMA-BAS-ENs 内的内皮细胞发育良好且连续。更重要的是,这些结果证实了载入囊泡的仿生骨支架系统促进了宿主血管的生长,加速了桡骨的再生。此外,还在植入后 12 周进行了免疫组化染色(BMP-2、Runx2 和 OCN),以研究骨再生过程中可能存在的成骨相关表达(图 4C-E)。定量分析显示,在 PCLMA-BAS-ENs 组中,BMP-2、Runx2 和 OCN 的骨相关表达水平均有所提高(图 4F)。总之,这些结果表明,负载 ENs 的仿生骨支架可以调节体内局部成骨微环境,促进骨再生和修复。
图3 PCLMA-BAS-ENs支架修复兔骨缺损的实验研究
图4 第12周时再生组织的代表性染色图像
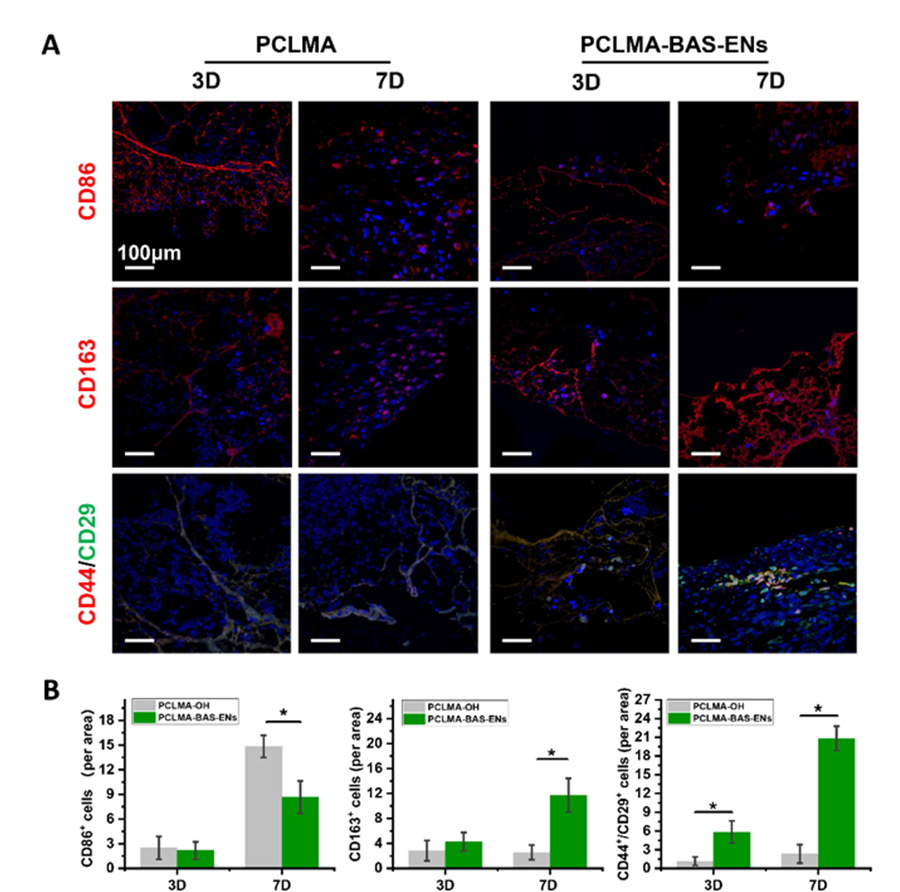
作者在第3天收集植入兔子骨缺损部位的支架,包括3个负载囊泡的支架(PCLMA-BAS-ENs 组)和3个装有纯材料的支架(PCLMA 组),并洗脱支架表面的蛋白质进行蛋白质组学分析。本研究根据定量蛋白质组学和 DIA 的显著性标准(FC > 1.2,P < 0.05)鉴定了857个上调蛋白质和37个下调蛋白质,并将数据以火山图(图 6A)和直方图(图 6B)的形式呈现。KEGG 通路分析揭示了差异表达的蛋白质。更具体地说,前20个蛋白质富集在多个生物学过程中,如氧化磷酸化、cAMP 信号通路、cGMP-PKG 信号通路、白细胞跨内皮迁移、趋化因子信号通路等(图 6C)。同时,GO 富集分析表明,差异蛋白参与了细胞对干扰素-γ 的反应、氧化还原过程、正趋化作用、对表皮生长因子的反应、中性粒细胞趋化作用的正调控等(图 6D-F)。为了进一步阐明仿生支架促进成骨的细胞学机制,分别在第3天和第7天对 PCLMA-BAS-ENs 组和 PCLMA 组(n = 6)进行了免疫荧光染色,定量结果显示,在第7天、 M1型巨噬细胞相关标记物CD86在PCLMA-BAS-ENs组的表达水平低于PCLMA组,而M2型巨噬细胞相关标记物CD163在PCLMA组的表达水平低于PCLMA组。此外,在第 7 天,PCLMA-BAS-ENs 组的 rBMSC 相关标记物 CD44 和 CD29 的表达水平也明显高于 PCLMA 组,而且可以明显观察到骨髓间充质干细胞聚集(图 5A 和 B)。
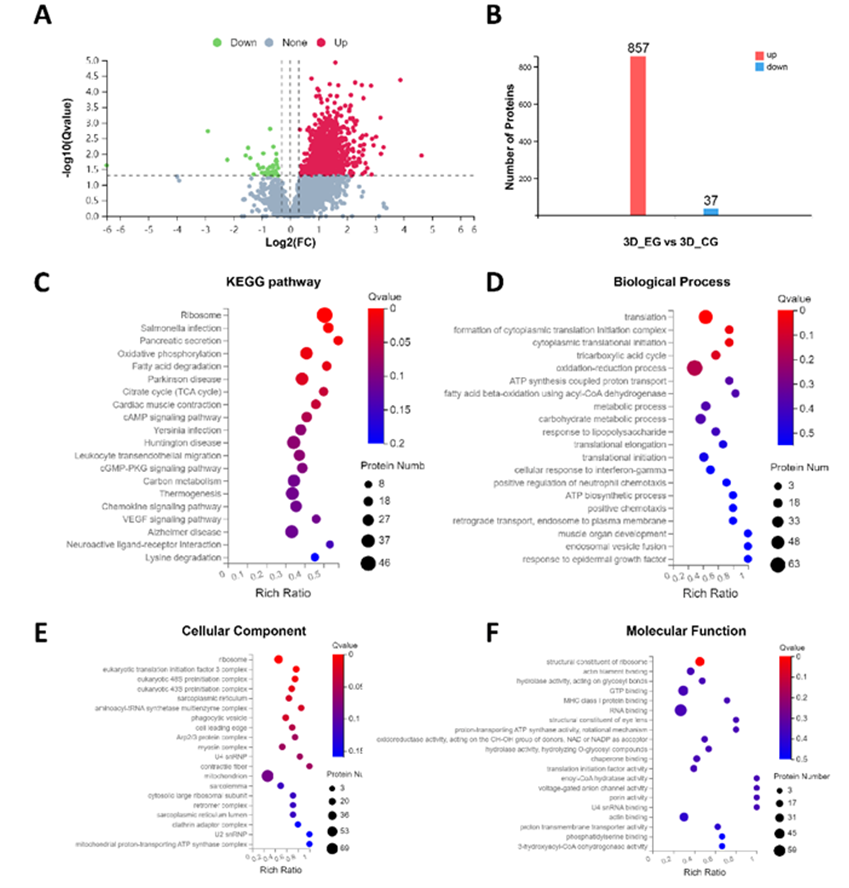
图6 仿生骨诱导支架对局部成骨微环境的影响的调控机制
总之,这项研究成功地利用DLP 3D打印技术制备了高精度的仿生骨支架,并通过灌流装置将生物素标记的工程化纳米囊泡修饰于其上。这种精心设计的仿生支架负载丰富的工程化纳米囊泡,建立了一个有利于成骨的微环境。体内实验进一步证实了其促进大段骨缺损修复的能力,可归因于其早期的免疫调节、促进血管生成和促进成骨反应。因此,本研究为功能化高精度仿生支架的研究提供了一种有前景的策略,为骨缺损微环境的局部调控铺平了道路。
孙家明教授,陈雳风博士为论文的共同通讯作者,华中科技大学同济医学院附属协和医院整形外科2022级博士生姜文彬为文章的第一作者,华中科技大学同济医学院附属协和医院整形外科为第一通讯单位,武汉市浅表器官再造与修复临床研究中心为共同通讯单位。研究得到了科技部重点研发计划2019YFA0110500, 国家自然科学基金(82020108020, 82072198, 82002067),中国博士后科学基金(2021M690063)等项目资助。
参考文献:
Synergistic large segmental bone repair by 3D printed bionic scaffolds and engineered ADSC nanovesicles: Towards an optimized regenerative microenvironment. Biomaterials. Published online April 8, 2024. doi:10.1016/j.biomaterials.2024.122566
外泌体资讯网 Biomaterials|华中科技大学孙家明/陈雳风:3D打印仿生支架与工程化 ADSC 纳米颗粒协同修复大段骨:优化再生微环境