目前,心血管疾病仍然是世界范围内发病率及致死率最高的病症之一。其中,急性心肌梗死是其最严重的表现形式。近年来,外泌体已成为一种新兴的无细胞治疗策略,在急性心肌梗死、心力衰竭和心肌病等心血管疾病的治疗方面发挥重要作用。团队前期研究证实,外泌体能够部分模拟母细胞的功能,其中间充质干细胞分泌的外泌体可减少心梗后心肌细胞凋亡,促进血管新生,调节免疫反应,从而减少心梗面积和改善心脏功能。近日,南京医科大学附属常州二院孙铃、纪元、王庆捷课题组在Int J Nanomedicine上发表题为“Engineered Exosomes with Growth Differentiation Factor-15 Overexpression Enhance Cardiac Repair after Myocardial Injury”的原创性文章(2024:19 3295–3314)。研究生邹艾霖、肖婷婷为共同第一作者。该研究获得包括国家自然科学基金在内的多项科研项目支持。
外泌体是直径大约为40-100nm的细胞外囊泡,由质膜衍生的脂质双层形成,含有多种生物活性分子,如脂质、蛋白质和RNA,可参与基因调控、免疫调节、细胞分化迁移、物质代谢等生物过程。众所周知,外泌体参与细胞间通讯,是一种富有前景的无细胞治疗新策略。生长分化因子-15(GDF-15)是转化生长因子β超家族中的一员,属于应激反应蛋白,参与调节组织损伤以及疾病进程中的炎症和凋亡水平。已有研究证实GDF-15是一个重要的心血管保护因子,在缺血-再灌注、压力负荷和心衰的情况下具有抑制心肌细胞凋亡及心肌肥厚,改善心室重构和抗炎的作用。此研究旨在探讨心肌损伤后过表达GDF-15的工程外泌体(GDF15-EVs)的作用及其在心脏修复中的分子机制。在这项工作中,研究人员首先成功构建工程化的高表达GDF-15的外泌体,并证实其可被心肌细胞摄取吸收进而发挥生物学功能。在此基础上进行了后续实验,发现GDF15-EVs 在急性心肌梗死后大鼠模型中通过减少心肌纤维化面积和炎症反应、促进血管生成和抑制心肌凋亡,改善心脏功能,证实了其对缺血性心脏病的有效治疗价值。
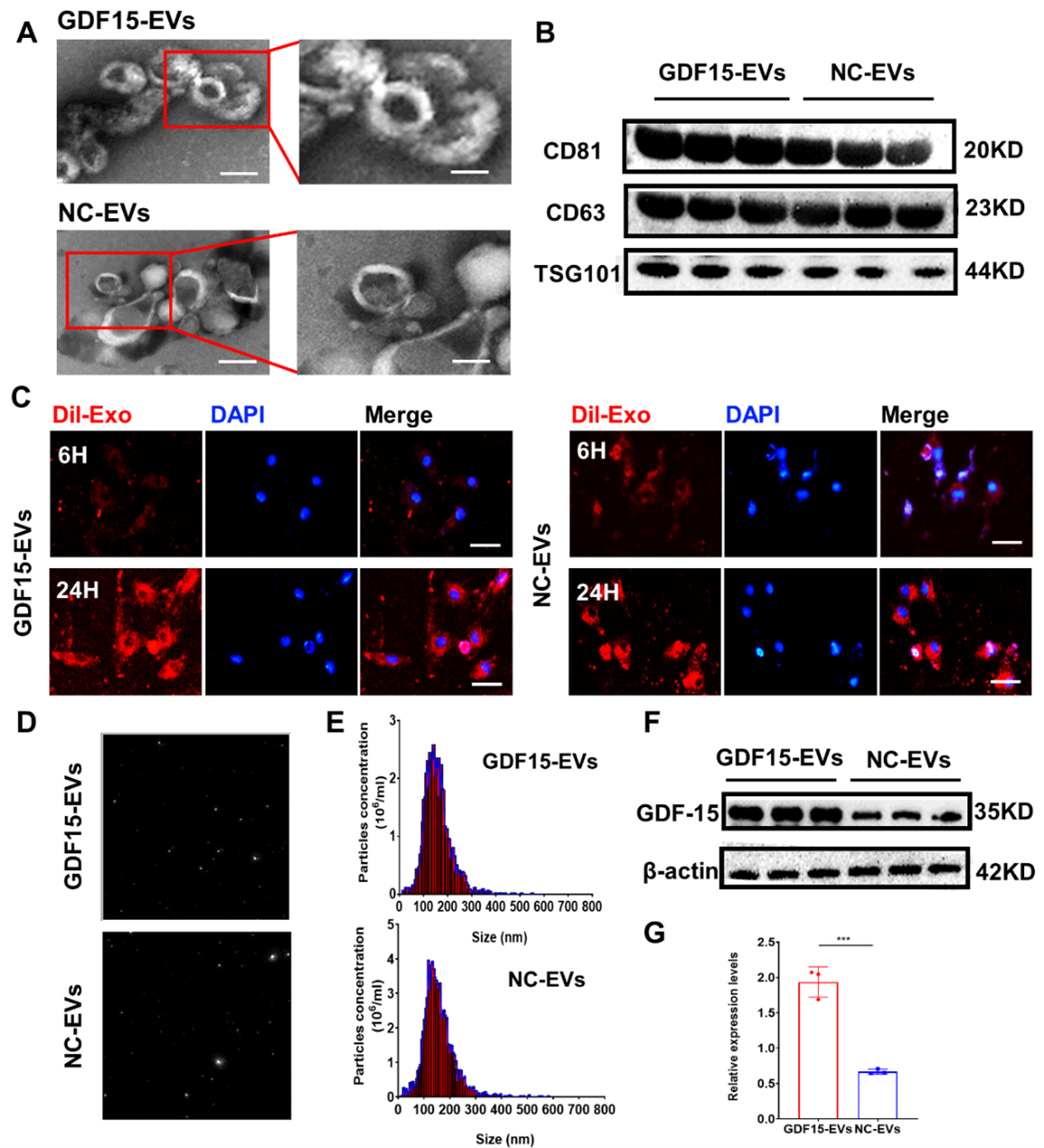
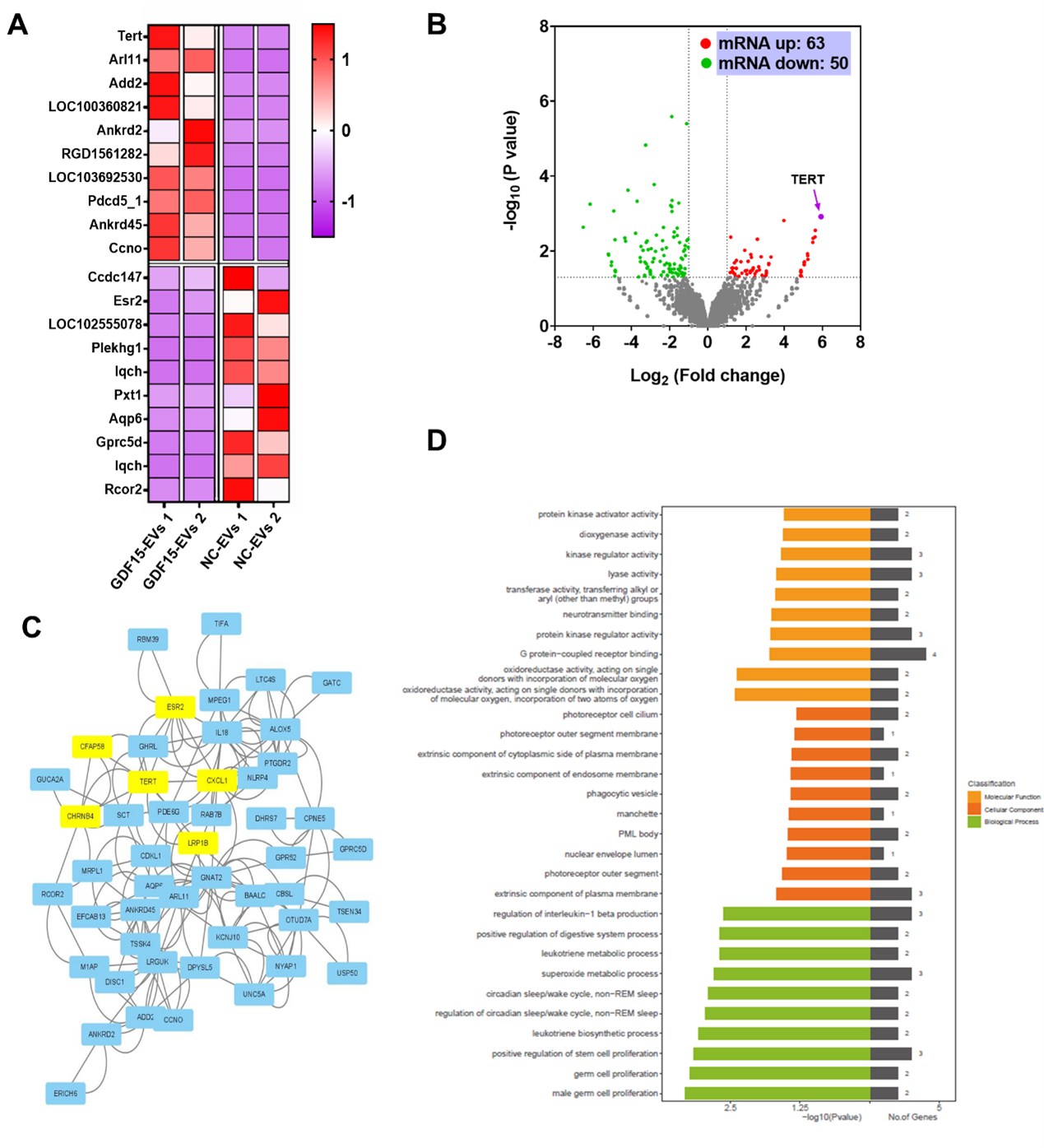
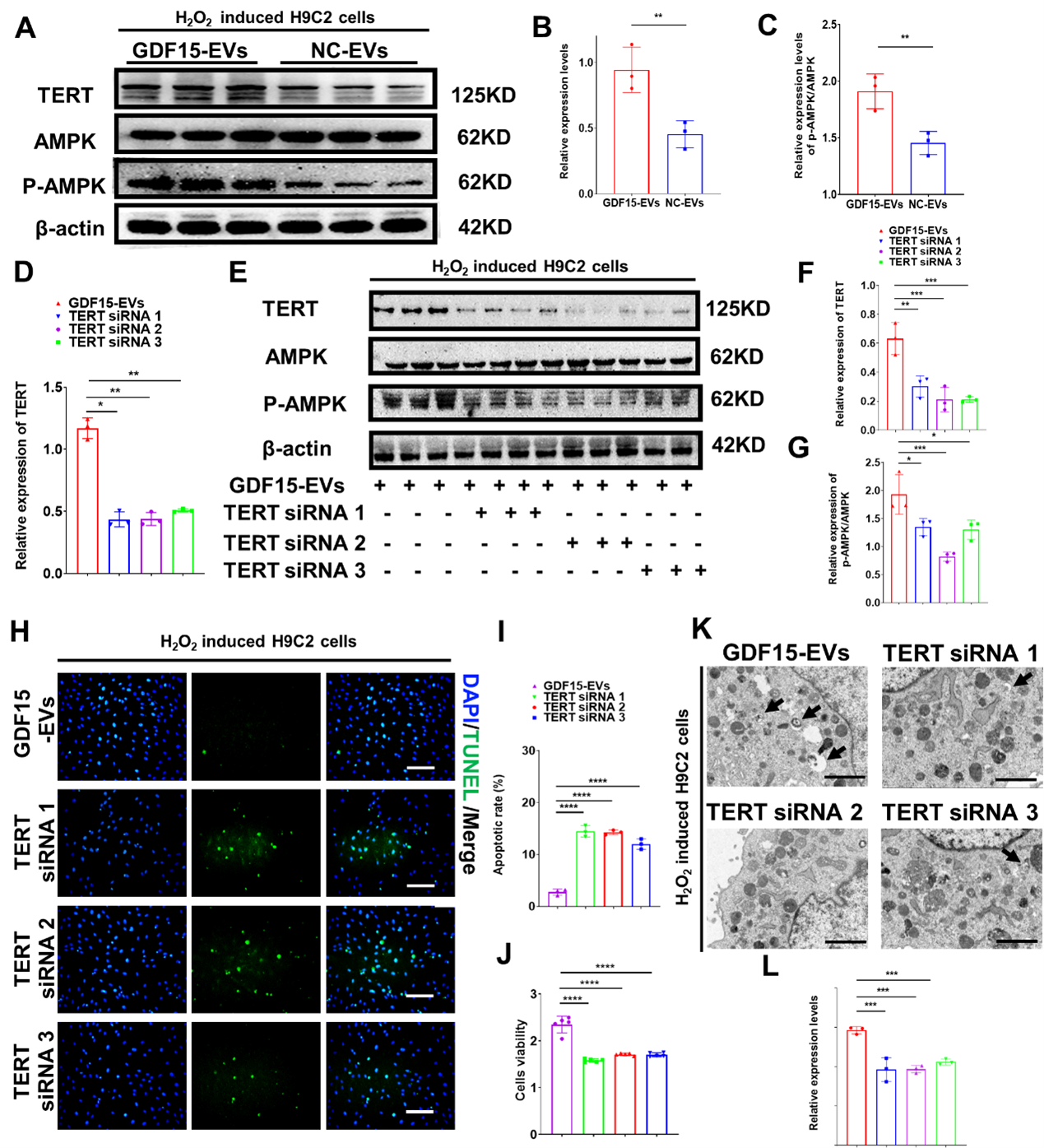
转录组测序结果显示:端粒酶逆转录酶(TERT)mRNA在GDF15-EVs处理的H9C2细胞中上调。GDF15-EVs治疗后,H9C2细胞中AMPK信号被激活。而沉默TERT会削弱GDF15-EVs对心肌损伤的保护作用。这些结果表明GDF15-EVs可通过上调TERT的表达和激活AMPK信号通路来发挥其对心肌损伤的保护作用。该研究中主要解决的问题是成功构建了工程化的具有心肌修复作用的外泌体,对未来的临床转化具有重要的意义。外泌体最终进入临床并造福患者,其实还有很长的一段路要走。当前研究仍集中在概念验证上。未来,团队或将进行一些大动物实验,为外泌体的临床转化提供更多的临床前证据,进而为缺血性心脏病患者的治疗提供新的思路及策略。Engineered Exosomes with Growth Differentiation Factor-15 Overexpression Enhance Cardiac Repair After Myocardial Injury.Int J Nanomedicine. 2024;19:3295-3314. Published 2024 Apr 6. doi:10.2147/IJN.S454277外泌体资讯网 Int J Nanomedicine|南京医科大附属常州二院:过表达生长分化因子-15的工程化外泌体促进心肌损伤后的心脏修复能力