癌症疫苗通过诱导全身性、肿瘤特异性免疫应答,在癌症免疫治疗中提供了一个有希望的途径。肿瘤细胞外囊泡(TEVs)是自然携带肿瘤抗原的纳米颗粒,成为疫苗开发的有吸引力的对象。然而,TEVs从原始肿瘤细胞中带来的固有的恶性特性限制了它们的直接治疗用途。近日,来自韩国高丽大学的研究人员介绍了一种新的方法,将TEVs重新用作强效的个性化癌症疫苗。他们发现,抑制YAP和自噬可以减弱TEVs的恶性相关特征,丰富TEVs的肿瘤抗原和佐剂负载,增强了免疫原性属性。这些改进后的TEVs被称为致癌减弱但免疫原性增强的TEVs(AI-TEVs),表现出抑制肿瘤生长的潜力,既作为预防措施,又作为复发性癌症可能的治疗手段。相关内容以“Novel Personalized Cancer Vaccine Using Tumor Extracellular Vesicles with Attenuated Tumorigenicity and Enhanced Immunogenicity”为题在线发表于4月26日的国际知名综合性学术期刊Advanced Science杂志上。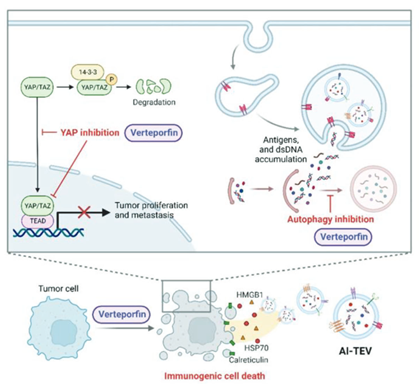
尽管近年来外科技术和新型癌症治疗策略取得了重大进展,但癌症复发的风险仍然很高,给无数患者带来威胁。因此,有必要开发一种基本方法,通过诱导全身性抗肿瘤反应并保留长期记忆,消除残余肿瘤并预防癌症复发。个性化癌症疫苗接种是最有前途的策略之一,通过使用直接从患者肿瘤组织中提取的多种抗原,设计个体化地诱发和增强肿瘤特异性免疫反应。然而,要开发成功的癌症疫苗,需要满足几个要求,如最佳的肿瘤抗原来源以及它们与免疫佐剂的组合,所有这些都必须在适当的传递平台中进行配方。尽管几十年来一直有大量努力开发个性化癌症疫苗,但大多数由于未能满足这些因素而显示出不令人满意的临床结果。肿瘤源性细胞外囊泡(TEVs)是从肿瘤细胞释放到细胞外环境中的脂质双层颗粒;它们由各种囊泡组成,最显著的是外泌体、凋亡小体和微囊泡。众所周知,它们具有反映原始肿瘤细胞特征的独特货物组成,如蛋白质、脂质和核酸,因此可以影响受体细胞的功能或表型。大量研究表明,TEVs携带肿瘤抗原,包括肿瘤相关抗原和肿瘤特异性抗原,被认为是抗肿瘤疫苗的最重要组成部分。此外,TEVs是天然的传递平台,表明它们成功传递抗原材料的能力。考虑到这些优势,TEVs因其巨大潜力作为肿瘤抗原并引发肿瘤特异性免疫反应而受到越来越多的关注。然而,众所周知,TEVs参与免疫抑制和促癌途径,使其不适用于抗癌疗法。因此,要利用TEVs作为有效的癌症疫苗平台,需要将它们与佐剂结合以诱导足够的免疫反应,以及一种方法来抑制TEVs的促癌特性。Verteporfin(中文名维替泊芬)是一种经美国食品药品监督管理局批准的药物,商业名称为Visudyne,主要用作光动力疗法的光敏剂,但也已知在各种疾病中具有其他机制。首先,它是一种强效的Yes-associated protein (YAP) 抑制剂,破坏了YAP与TEA/TEF-domain 转录因子(TEAD)之间的相互作用,并在细胞质中降解YAP。YAP-TEAD复合物是Hippo通路的主要调节因子,调节细胞增殖、存活和迁移,因此YAP成为各种肿瘤类型中的癌基因。多项研究表明,YAP抑制减弱了肿瘤细胞的致瘤功能。这一理解促使了一种假设,即Verteporfin介导的YAP抑制可能降低TEVs的致瘤性。此外,已经证实Verteporfin介导的YAP依赖性细胞死亡具有免疫原性,表明YAP抑制可能通过免疫原性细胞死亡(ICD)介导免疫反应。ICD是一种有前途的癌细胞死亡方式,其中死亡细胞显示增加的抗原性和佐剂性,激活特异性抗原免疫反应,从而诱导强效的适应性免疫反应。因此,如果Verteporfin治疗在肿瘤细胞中诱导ICD,细胞将显示增加的抗原性和佐剂性,这将反映在它们分泌的TEVs中,这些TEVs也将增强免疫原性。其次,Verteporfin是一种公认的自噬抑制剂,主要通过交联自噬中的关键支架蛋白p62,从而阻止自噬体的形成。自噬调节不仅与损伤的双链DNA在细胞质中的积累有关,随后将它们转运到排出的EVs中,而且与肿瘤抗原的呈现增加有关。EV负载的DNA片段可以在接收到的树突状细胞(DCs)中激活cGAS-STING通路,引发强烈的免疫反应。因此,研究人员猜想,Verteporfin在肿瘤细胞中抑制了自噬和YAP蛋白并同时诱导了ICD,它可能导致肿瘤细胞分泌含有大量双链DNA和其他免疫原性的TEVs,例如肿瘤抗原和损伤相关分子模式(DAMPs),同时消除了它们原始的促肿瘤特性。在本研究中,研究人员利用Verteporfin在小鼠模型中的作用机制,开发致癌性弱化但免疫原性增强的TEVs(AI-TEVs)。此外,研究人员验证了AI-TEVs的生成以及它们在治疗和预防接种模型、癌症复发和个性化接种模型中的有效性。研究人员发现,AI-TEVs促进了肿瘤特异性和持久的免疫记忆。本研究通过展示AI-TEVs可以在个性化疫苗方法中抵消癌症生长,提出了一个潜在的策略,用于开发持久且量身定制的术后癌症免疫治疗,以适应患者个体化治疗。参考文献:Novel Personalized Cancer Vaccine Using Tumor Extracellular Vesicles with Attenuated Tumorigenicity and Enhanced Immunogenicity. Adv Sci (Weinh). 2024 Apr 26:e2308662.外泌体资讯网 Adv Sci丨经过改造的肿瘤来源细胞外囊泡作为新型个性化癌症疫苗





