胞外囊泡(EVs)作为一种有前景的药物递送载体正在崭露头角,因为它们具有良好的生物相容性并能够进行靶向递送。然而,由于缺乏标准化和可扩展的制造方案,难以稳定地分离出高产量和高纯度的小型EVs(sEVs),使得EVs的临床转化仍具挑战性。sEVs的异质性导致其生物货物成分未知,进一步引发了安全性方面的担忧。为了解决这些问题,该研究开发了一种稳健的质量控制多阶段工艺,从人类胚胎肾HEK293F细胞中生产和分离sEVs。然后,比较了不同的两步和三步工作流程,以消除蛋白质杂质和无细胞核酸,从而达到监管机构的可接受限度。
胞外囊泡(EVs)是由脂双层膜包裹的纳米级囊泡,由几乎所有细胞分泌。根据其形成方式,EVs可以分为外泌体、微囊泡和凋亡小体;也可以根据尺寸分为小型EVs(sEVs)——直径小于200纳米,和大型EVs。除了在治疗和诊断应用方面具有巨大潜力外,sEVs由于其内在的生物相容性、能够绕过生物屏障并特别是将货物递送到特定的细胞群体,正被积极研究作为一种替代的药物递送系统。然而,正在进行的研究sEVs作为药物递送平台的临床试验占总EVs研究的比例不到10%。sEVs相对于合成系统(如脂质纳米颗粒)的优越性和其利益风险比仍然存在争议。
开发基于sEVs的治疗方法的主要挑战是缺乏标准化的大规模分离和纯化高质量sEVs的方法。已经开发了几种基于尺寸、密度、电荷和免疫捕获的sEVs纯化方法;每种方法在产量、纯度、质量、成本和可扩展性方面都有其缺点。常见的可扩展且兼容良好生产规范(GMP)的方法有切向流过滤(TFF);超速离心(UC),包括直接UC、密度梯度UC或蔗糖垫;和尺寸排阻色谱(SEC)。结合多种sEVs纯化方法已被证明在sEVs纯度方面优于单一方法,无论起始材料如何。这些研究中的大多数涉及2步工作流程以不同顺序组合,而很少有研究检查三种或更多方法。虽然在纯化过程中增加更多步骤可能会进一步提高纯度,但最终的sEVs产量和完整性可能会受到影响。
开发sEVs作为药物递送载体的另一个挑战是可扩展的sEVs来源,以实现高产量生产,同时具有出色的可重复性和良好记录的安全性。间充质干细胞(MSCs)和癌细胞系已被广泛用于研究,甚至在临床试验中用于递送合成货物。由于这些细胞来源的sEVs也携带反映其亲本细胞生物状态和功能的生物货物,对潜在的致癌性和反复剂量对免疫系统影响的长期安全性提出了担忧。特别是对于MSCs,高批次间不一致性、含血清培养基中的动物蛋白污染和成本效益的规模化生产仍然是需要解决的问题。另一方面,一种有前景的sEVs药物递送来源是人类胚胎肾HEK293F细胞,这些细胞在使用化学定义的无血清培养基中悬浮快速生长。这是唯一一种不源自癌症的研究充分的永生化人细胞系。然而,与MSCs或其变种HEK293T细胞相比,HEK293F细胞产生的sEVs尚未被完全表征。
这项研究在搅拌罐生物反应器(STR)中培养HEK293F细胞以生产sEVs。彻底检查了不同的2步和3步工作流程,并优化了一种新的稳健方法,结合TFF、蔗糖垫UC,随后是结合洗脱SEC,大大提高了纯度,同时仍保持了高产量的sEVs。然后,对纯化的HEK293F来源sEVs进行了广泛的鉴定、内容分析以及体内和体外的安全性和免疫原性评估。
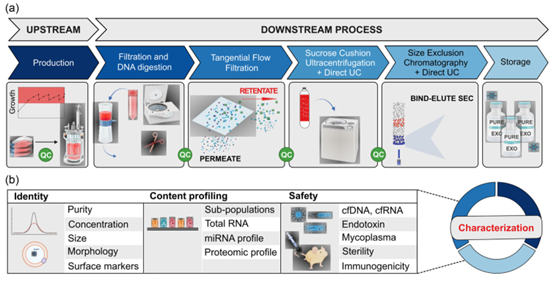
sEV生产、富集和表征的工作流程。
(a) 从摇瓶到搅拌罐生物反应器中规模化HEK293F细胞以进行sEV生产。将培养基进行预过滤和核酸消化,然后经过三步分离和富集过程,包括切向流过滤、蔗糖垫超速离心和使用Capto Core 700多模树脂的结合洗脱尺寸排阻色谱。纯化的sEVs被重悬于储存缓冲液中并储存在-80°C。每一步都进行质量控制测量。
(b) 对纯化的sEVs进行全面表征,包括鉴定、内容分析和安全性评估。
研究结果表明,当HEK293F细胞在半连续培养的高密度静相中生长时,sEVs的产量最大化。结合切向流过滤、蔗糖垫超速离心和结合洗脱尺寸排阻色谱的新型三步工作流程在sEVs纯度方面优于其他方法,同时仍保持了高产量和粒子完整性。经过纯化的HEK293F来源的sEVs被彻底表征,包括亚群分析、内容分析(包括蛋白质组学和miRNA测序),并在体外和体内测试中表现出优异的临床前安全性。严格的富集工作流程和全面的表征将有助于推动EVs的发展,特别是HEK293F来源的sEVs,成为安全可靠的治疗药物载体。
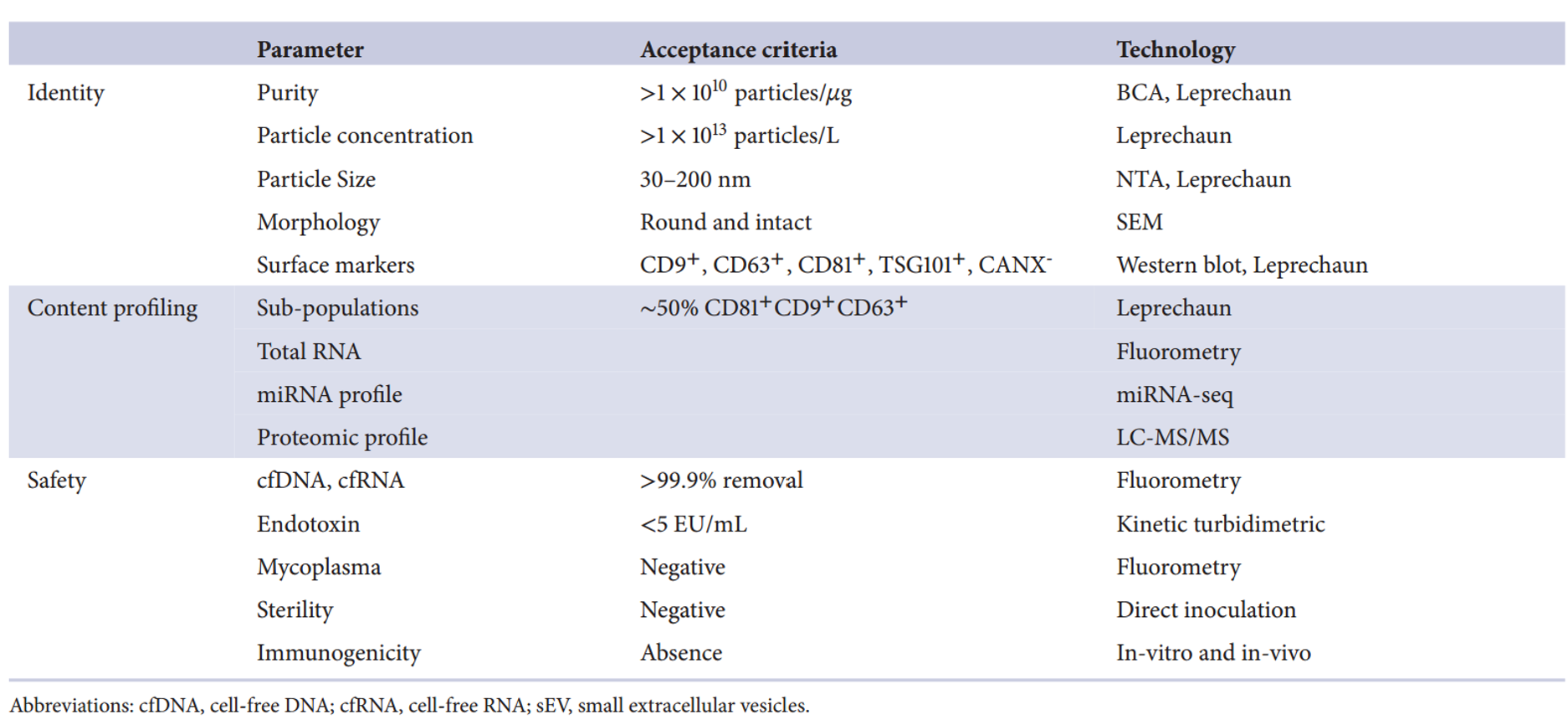
sEV特性标准
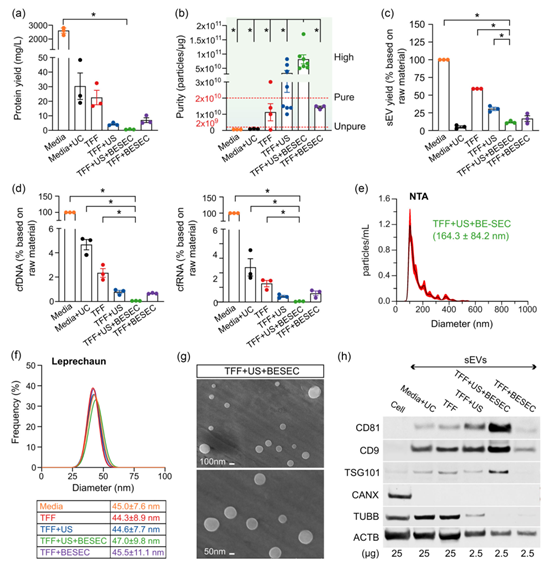
四种分离和富集工作流程的性能比较
总之,该研究报道的多阶段工作流程可稳健且可重复地生产出超纯的sEVs,并在不同批次之间保持稳定的特性,且高度适应大规模生产。尽管该方案需要进行调整以扩大规模并符合GMP标准,但由于在每一步分离和富集中的严格质量控制标准,以及符合国际胞外囊泡学会(Lotvall et al., 2014)建议的sEVs表征标准,过渡将会加速。这种标准化的工作流程能够为开发sEVs作为安全可靠的治疗药物载体的持续努力做出贡献。
参考文献:
Vo N, Tran C, Tran NHB, Nguyen NT, Nguyen T, Ho DTK, Nguyen DDN, Pham T, Nguyen TA, Phan HTN, Nguyen HN, Tu LN. A novel multi-stage enrichment workflow and comprehensive characterization for HEK293F-derived extracellular vesicles. J Extracell Vesicles. 2024 May;13(5):e12454. doi: 10.1002/jev2.12454. PMID: 38760878; PMCID: PMC11101607.