近日,外泌体治疗公司Evox Therapeutics Ltd(“Evox”)宣布,其资助的研究成果已在高影响力期刊Nature biomedical engineering上发表了同行评审论文,报道了靶向外泌体显著提高治疗性载荷递送能力的研究结果。
过去几十年中,癌症治疗的主要改进之一涉及抗体的靶向治疗,例如抗HER2(人类表皮生长因子受体2)治疗乳腺癌,以及最近的免疫检查点抑制的免疫疗法。主要的靶点之一是程序性细胞死亡蛋白1(PD-1)及其配体PD-L1。尽管PD-L1在多种恶性肿瘤中过表达,但只有一部分患者表现出持久的反应。提高响应率的策略包括与化疗的联合方法、多重检查点抑制和其他免疫刺激方法。然而,这些策略在将不同的治疗药物协调递送到感兴趣的靶点方面受到限制。一个有趣的替代方法是使用胞外囊泡(EVs),它们是有前景的药物递送纳米载体。EVs是一组异质的天然纳米囊泡,由所有细胞分泌。这些纳米囊泡的直径范围从30纳米到2000纳米不等,可以影响邻近细胞或远处的细胞。EVs含有来自源细胞的脂质、蛋白质和核酸物质,并具有通过先进的细胞间通信系统递送这些大分子的独特能力。重要的是,EVs能够跨越生物屏障到达远处器官,并可以通过工程改造显示靶向基团并装载各种治疗货物分子。近年来,EVs受到越来越多的关注,目前有许多临床试验正在进行中,以评估EVs的治疗潜力。
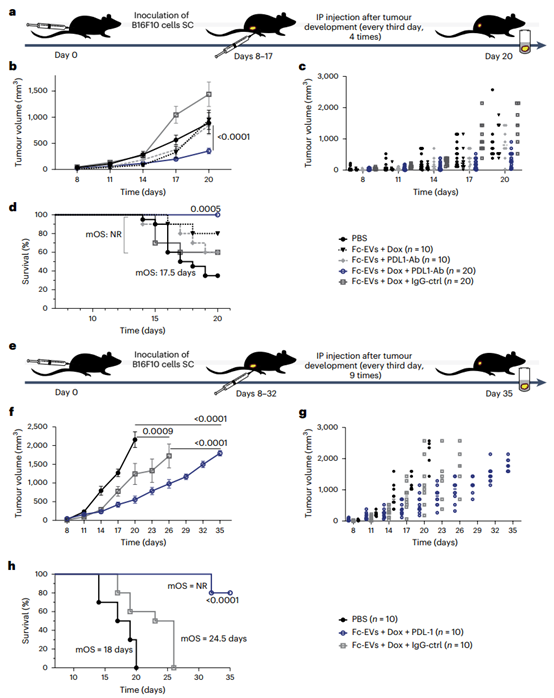
在这篇文章中,作者利用EVs作为递送载体的能力,并在其表面装备了一种Fc域的抗体结合基序。这些Fc结合的Fc-EVs可以装饰不同类型的IgG抗体,因此可以靶向几乎任何感兴趣的组织。以癌症治疗作为模型系统,研究人员展示了外泌体对癌细胞的高效靶向,包括HER2和PD-L1阳性细胞。作为概念验证,展示PD-L1抗体的Fc-EVs在系统给药后在肿瘤组织中的积累量提高了约40倍,并且当装载阿霉素时,显著降低了肿瘤负担并明显延长了携带肿瘤的小鼠的生存期。这项研究是在Evox与其联合创始人Samir El Andaloussi教授的团队合作下进行的。
该研究提出了一种高度模块化的EV疗法技术。利用分子工程工具,开发了能够结合抗体片段可结晶区(Fc)的EVs,使得可变区能够显示以识别抗原。这种Fc结合的EVs(Fc-EVs)可以装饰不同类型的抗体,从而靶向基本上任何感兴趣的组织。在此,Fc-EVs技术被设计为一种靶向癌症治疗,使用肿瘤特异性治疗抗体引导EVs至肿瘤细胞并递送抗肿瘤药物。
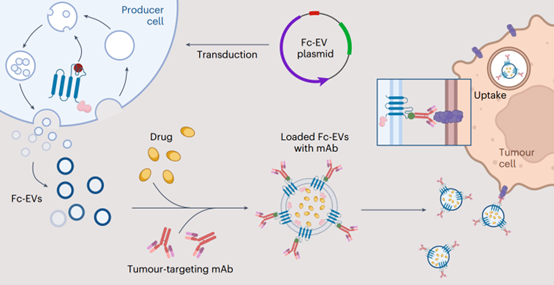
胞外囊泡(EVs)作为天然的递送载体和生物信号的介质在组织间发挥作用。通过利用这些功能,该研究展示了装饰有特异性结合抗体片段可结晶区(Fc)域的结合基团的EVs可以作为一种模块化的递送系统用于靶向癌症治疗。Fc-EVs可以装饰不同类型的免疫球蛋白G抗体,因此可以靶向几乎任何感兴趣的组织。在通过筛选Fc结合和EV分选基团优化工程化EVs后,该研究展示了EVs靶向展示人类表皮生长因子受体2(Her2)或程序性死亡配体1(PD-L1)的癌细胞,以及在系统性注射展示PD-L1抗体并装载化疗药物阿霉素的EVs后,皮下黑色素瘤肿瘤小鼠的肿瘤负担降低和存活时间延长。具有Fc结合域的EVs可以适应展示其他Fc融合蛋白、双特异性抗体和抗体-药物偶联物。
总之,Fc-EV技术提供了一种结合EV-抗体疗法,其中靶向和/或治疗抗体促进了携带治疗货物的EV的靶向递送,从而产生协同效应。理论上,该技术可以应用于无数的适应症,并用于多种组合,不仅限于经典抗体,还可以包括Fc融合蛋白、抗体-药物偶联物和双特异性抗体等。后续对Fc-EV概念的研究有望进一步探索其治疗潜力,并可能将其转化为临床应用。
“这项研究展示了我们的Fc-EV技术作为一种临床前筛选工具的广泛实用性,用于在开发靶向外泌体治疗时识别最佳的配体-受体对,”Evox研究负责人Dave Carter博士说。“许多基因药物的靶向递送,如基因组编辑器,将变得越来越重要,以避免不必要的脱靶效应,我们的外泌体平台技术在这方面提供了独特的解决方案。”





