小细胞外囊泡(sEVs)是天然存在的囊泡,具有潜力被操纵成为有望成为需求型体外和体内基因编辑的有前途的药物递送载体。来自美国哥伦比亚大学的研究人员设计了一种工程化sEVs——safeEXO,用于CRISPR/Cas机制的有效、靶向和可扩展传递,并在体外和体内展示了高效的基因编辑,不引起免疫原性反应或非靶向效应。经过工程改造,研究人员实现了(1)最小化内源性核酸载荷(safeEXO)、(2)内源性携带活性Cas9蛋白(safeEXO-CAS)、(3)表达组织特异性靶向物质。相关内容以“Small extracellular vesicles (sEVs)-based gene delivery platform for cell-specific CRISPR/Cas9 genome editing”为题在线发表于4月28日的国际知名综合性学术期刊Theranostics杂志上。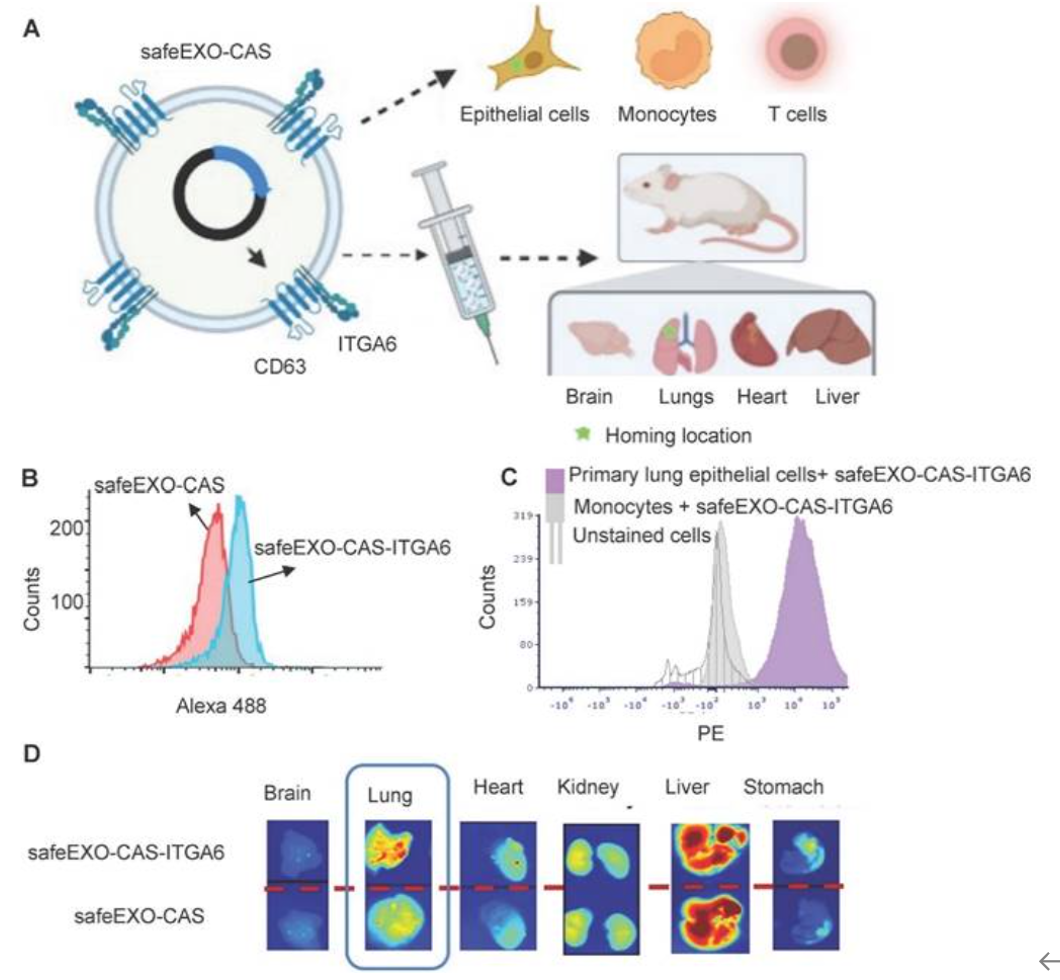
小细胞外囊泡(sEVs)是一种纳米大小(70-200纳米)的膜结合囊泡,存在于生物体液中,并由几乎所有类型的细胞在细胞微环境中分泌。它们自然携带生物大分子,包括不同的RNA(mRNA、microRNA)、DNA、脂质和蛋白质,并能够有效地将它们的载荷传递给受体细胞,介导细胞间通信和功能。先前工作已经显示了利用sEVs进行药物递送的优势。小细胞外囊泡 1) 由于与细胞膜的相似性,体积小且具有高效的递送效率;2) 具有生物相容性、非免疫原性和非毒性,即使进行多次体内注射也是如此;3) 即使经过多次冻结和解冻循环,仍然稳定;4) 包含脂质双层,可保护其蛋白质和RNA载荷不受蛋白酶和RNase等酶的影响;5) 具有轻微的负ζ电位,导致长时间循环;6) 表现出逃逸免疫系统降解或清除的能力增加。因此,外源性sEVs正被开发用于递送干扰RNA(RNAi)、miRNAs和mRNA,并且在未来的治疗应用中具有巨大潜力。CRISPR/Cas基因组编辑系统近年来被广泛应用,因其产生有针对性的基因组编辑的能力而得到了充分利用。该技术正在迅速发展成为一种临床级别的技术,用于特定的遗传疾病,并正在积极探索用于各种疾病。然而,其广泛的治疗应用仍然存在挑战,部分原因是缺乏一种有针对性、可靠且安全的传递方法,用于必需的基因编辑组分。sEVs作为基因编辑载体呈现出有希望的前景,但需要创新方法来克服几个挑战,以成功利用它们作为可扩展、有针对性和可靠的载体,用于CRISPR/Cas有效促进基因编辑,而不会产生不必要的生物效应或未知的内源性载荷。CRISPR基础编辑以有针对性地诱导双链DNA(dsDNA)断裂为特征,促使通过非同源末端连接(NHEJ)或同源有向修复(HDR)进行结果性DNA修复。NHEJ在没有模板的情况下发生,因此可能被利用来通过突变进行基因敲除、移位或引入新的终止密码子来进行基因敲除。NHEJ至少需要Cas核酸酶和单链向导RNA(sgRNA)。Cas加上单个sgRNA足以进行基因破坏/突变,而Cas加上两个sgRNA则可以进行基因敲除。HDR插入新的遗传材料,需要Cas、sgRNAs以及用于有针对性遗传插入的“备用”DNA模板。因此,HDR提供了在基因组的目标位置插入特定DNA序列的机会,以纠正遗传疾病或引入新的功能蛋白质,尽管与NHEJ相比效率要低得多。利用CRISPR/Cas治疗人类疾病的主要挑战之一是缺乏有效的传递方法,用于必需的复杂多组分机器,能够在体内靶向特定细胞和器官,并避免在非靶向细胞或基因位点进行基因编辑。CRISPR/Cas可以通过基因传递(编码Cas和sgRNA的DNA质粒或病毒)、基于RNA的传递(编码Cas的mRNA以及合成sgRNA)或形成的核糖核蛋白(RNP)复合物(由预先结合到合成sgRNA的Cas蛋白组成)局部或系统地传递。在这三种方法中,基于RNP的传递似乎更为优越,并且对编辑靶向基因组位点最为特异,因为它不依赖于不受控制的Cas蛋白整合或表达,尽管作为一种治疗方法,由于制造和有效传递完整、功能性的重组Cas核酸酶蛋白以及必需的sgRNA和DNA模板到疾病部位的复杂性,这也是最难实施的。尽管病毒和非病毒方法都已被采用用于CRISPR/Cas机制的体内传递,但有效地将多个CRISPR组分传递到宿主细胞中仍然是一个重大挑战。腺病毒(AV)是用于CRISPR/Cas介导的基因组编辑的有效转导剂,然而,这种方法可能在宿主体内引发显著的免疫反应。慢病毒载体被广泛用于治疗传递,尽管它们整合到基因组中使它们不太适合基因编辑目的。这些缺点导致了体内基因编辑核酸的分布和剂量的困难,从而产生了难以预测的非靶向突变谱。非病毒合成载体是另一类传递载体,它们缺乏组织趋向性,但如果与肽或抗体等靶向物质结合,它们可能提供靶向的细胞/器官特异性传递。然而,精确的靶向性特别难以实现,因为在CRISPR组分的传递载体中引入额外的生物分子会增加包装复杂性。合成传递载体的缺点包括生物相容性和毒性问题、免疫原性潜力以及治疗载荷释放问题。因此,通过病毒和非病毒传递的CRISPR/Cas机制目前存在挑战,这些挑战阻碍了对基因编辑的全面治疗利用,需要新的解决方案将基因编辑的科学进展转化为对患者的利益。虽然CRISPR/Cas9系统可以通过包括电穿孔在内的物理方法封装到sEVs中,但这些方法可能效率低下,因此已经设计出了基因工程的sEVs作为新型包装策略,以促进sEVs介导的CRISPR/Cas9传递的载荷装载。比如,通过GFP和GFP纳米体之间的融合,在GFP表达的sEV蛋白CD63和GFP纳米体表达的Cas9蛋白之间实现了有效的包装。将sEV表面蛋白CD9与能够识别工程化Cas9 mRNA表达的AU丰富元件(AREs)的 HuR基因融合,特异地富集了Cas9 mRNA到工程sEVs中,展示了一种有前景的mRNA载荷装载方法。特定细胞类型来源的sEVs可用于CRISPR/Cas9系统的靶向传递。来源于MSC的sEVs传递了CRISPR/Cas9系统,并成功地在体外抑制了胰腺癌细胞中的致癌突变KrasG12D,以减少肿瘤生长。来源于卵巢肿瘤的sEVs将CRISPR/Cas9系统选择性地编辑PARP-1,以增加卵巢癌细胞的化疗敏感性,并在与化疗结合时产生协同的细胞毒性。Dooley等人设计了一个多功能平台,使用骨架蛋白的截短版本,在这个平台上,将Cas9与MARCKS蛋白家族的EV骨架蛋白BASP1的N-端融合,将Cas9定向装载到腔内。这些成功的结果证明了工程sEVs以增强靶向传递的潜力,虽然还没有应用于CRISPR/Cas9,但基因修饰的sEVs增加了siRNA、mRNA或miRNA的传递的特异性。在这项工作中,研究人员开发了模块化的safeEXO平台,这是一个sEV递送载体,有效地将RNA和核糖核蛋白复合物传递到其预期的细胞内靶点,表现为下游的生物活性。研究人员工程化生产细胞来产生包含内源性Cas9的safeEXO载体(safeEXO-CAS),以有效地传递RNP介导的CRISPR基因编辑机器到器官或疾病细胞。研究证实了safeEXO-CAS sEVs能够共递送ssDNA、sgRNA和siRNA,并且能够有效地介导剂量依赖的基因插入。研究人员通过工程化sEVs表达组织特异性物质整合素α-6(safeEXO-CAS-ITGA6),增加它们在体外和体内对肺上皮细胞的摄取,测试了safeEXO-CAS sEVs的靶向潜能。研究测试了装载EMX1 sgRNA的safeEXO-CAS-ITGA6对小鼠进行肺靶向编辑的能力,结果显示肺部有显著的基因编辑,没有发现致病性迹象或可检测到的免疫细胞数量变化。该结果表明,模块化safeEXO平台代表了一个可靶向、安全和有效的载体,可以传递核酸为基础的治疗药物,成功地达到它们的细胞内靶点。此外,safeEXO生产细胞可以被基因操纵以产生含有CRISPR机器的safeEXO载体,以实现更有效的RNP介导基因编辑。这个平台有潜力改善当前的治疗方法,并通过RNAi和CRISPR方法扩大各种人类疾病的治疗范围。参考文献:Small extracellular vesicles (sEVs)-based gene delivery platform for cell-specific CRISPR/Cas9 genome editing. Theranostics. 2024 Apr 28;14(7):2777-2793.外泌体资讯网 Theranostics丨基于小细胞外囊泡的基因传递平台用于CRISPR/Cas9基因编辑