干细胞疗法(SCT)是再生疗法的重要组成部分,为许多患者带来了希望。经过几十年的发展,SCT在多种疾病的研究方面取得了重大进展,市场规模也显着扩大。SCT从小规模定制实验向常规临床实践的转变需要标准的帮助。全球多个国家和国际组织制定了相应的SCT标准,有力地促进了SCT产业的进一步发展。近日,大连医科大学附属第一医院、大连干细胞与精准医学创新研究院刘晶教授团队全面介绍了SCT应用现状,包括干细胞的类型和特点、SCT的临床应用和市场前景,同时从国际标准化组织(ISO)标准、区域组织标准和国家标准三个层次重点关注了SCT相关标准的涵盖范畴,并就SCT标准化的意义和挑战提供了观点和结论,为SCT标准化体系的完善和走向大规模临床应用提供新思路。相关研究内容以“Standardisation is the key to the sustained, rapid and healthy development of stem cell-based therapy”为题于4月14日在线发表在最新一期的国际权威期刊Clinical and Translational Medicine杂志上(医学1区,10.6分)。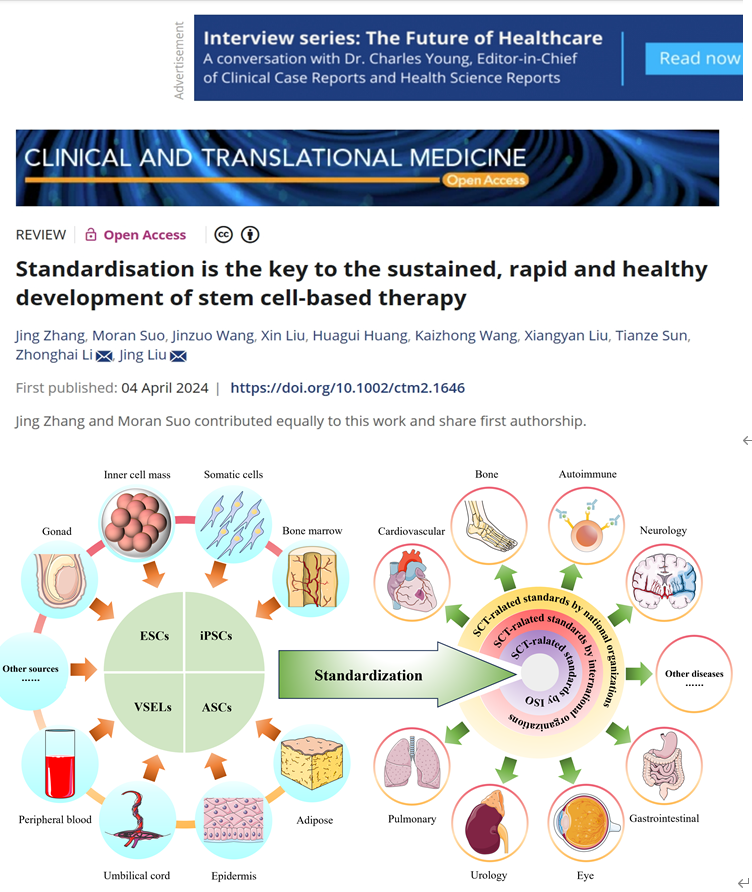
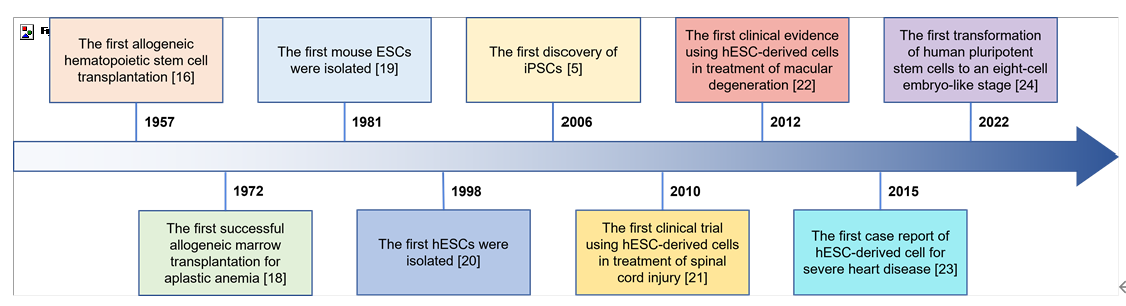
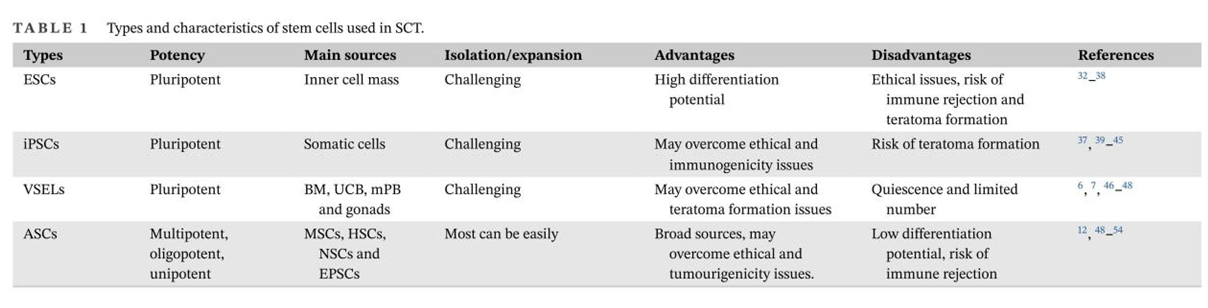
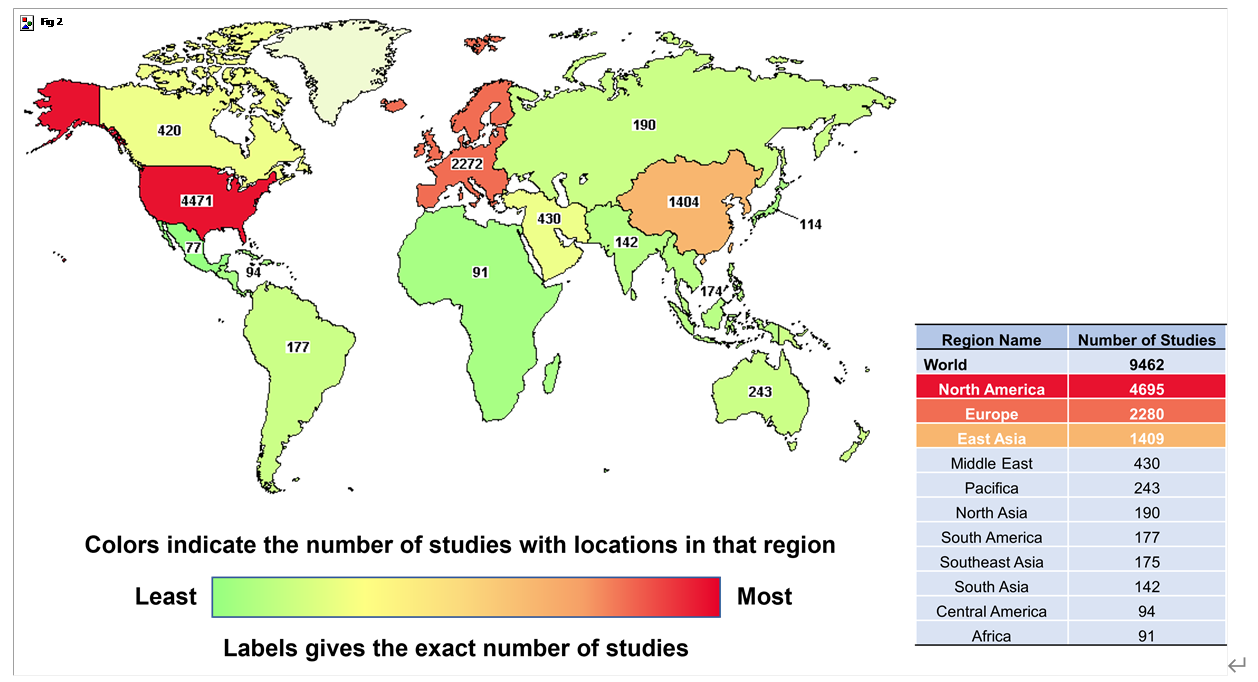
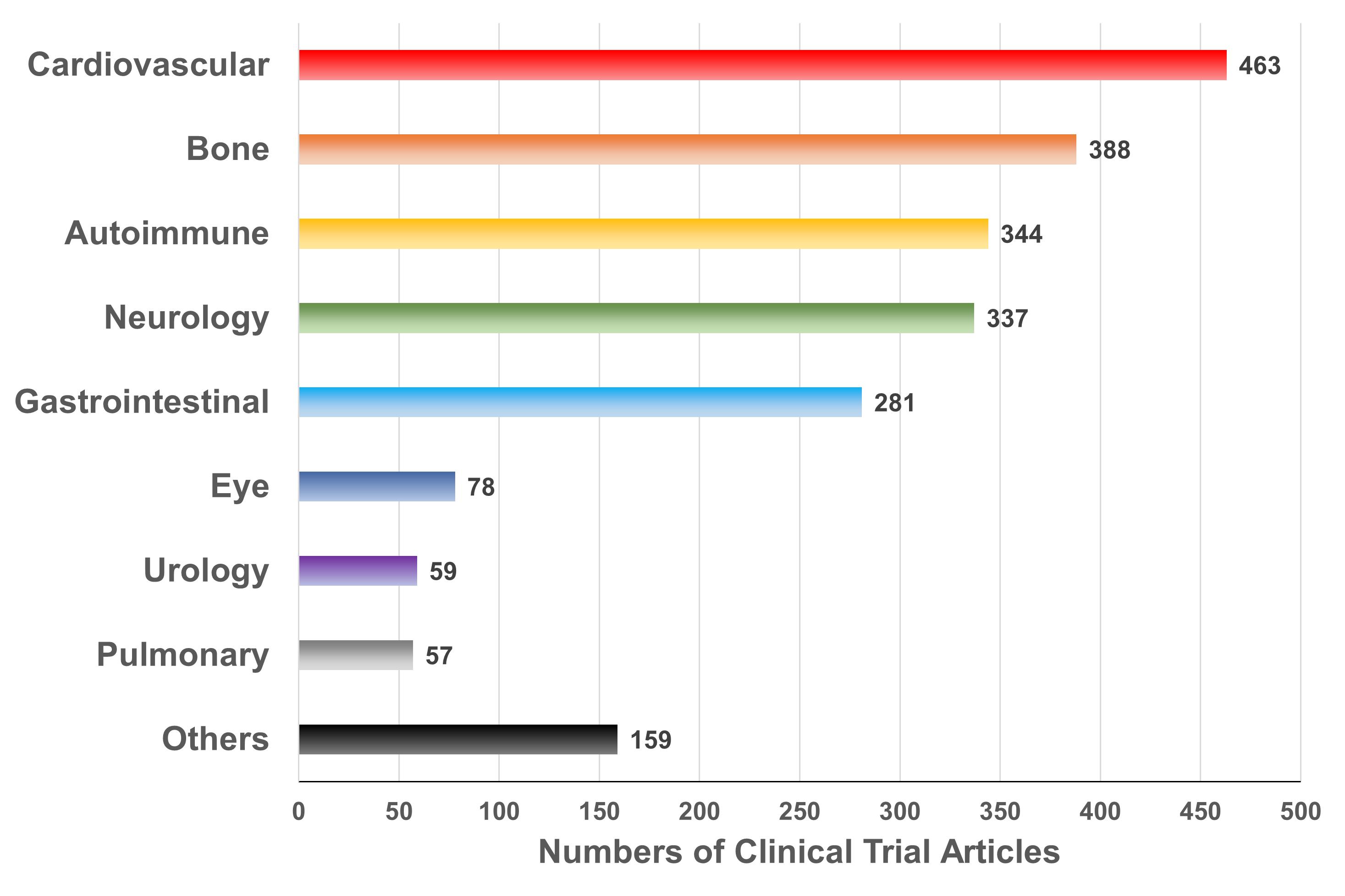
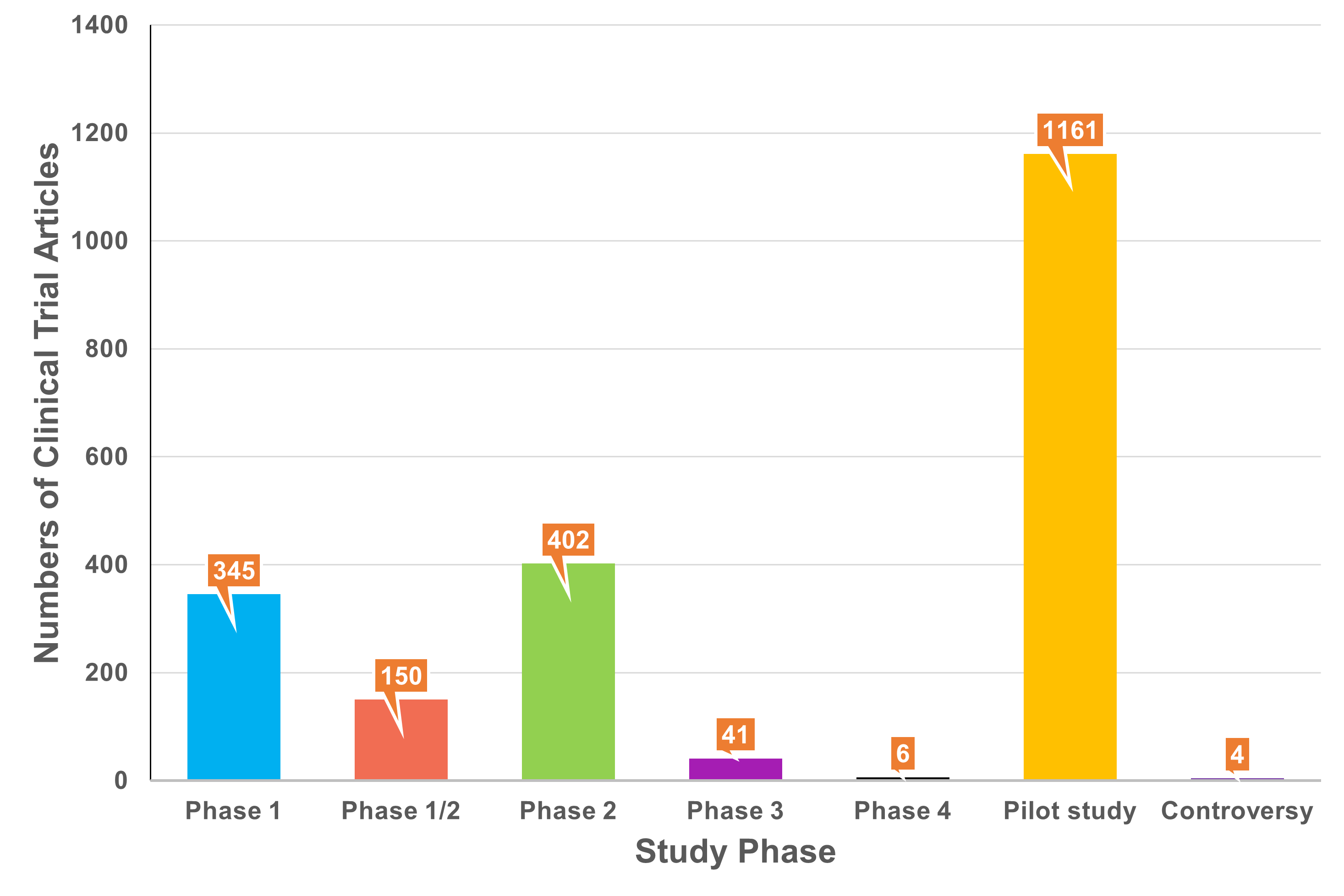
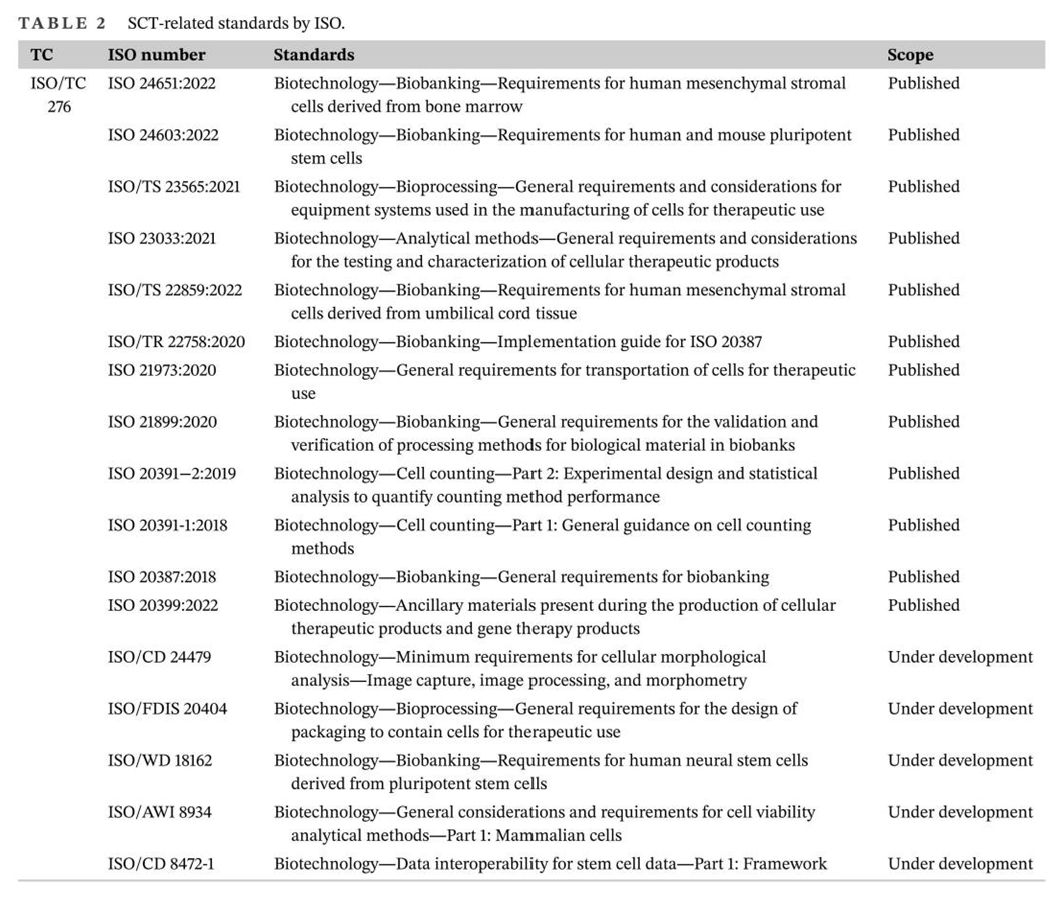
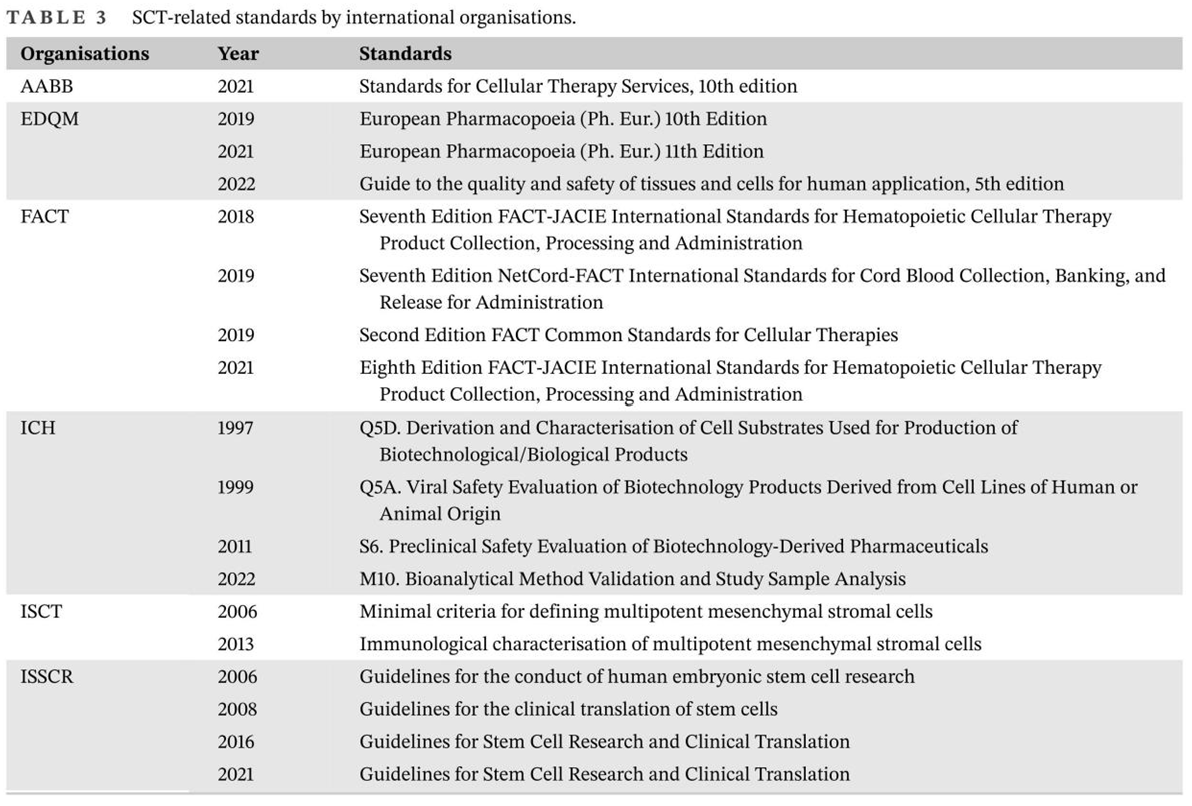
干细胞疗法(SCT)的目的是利用干细胞的独特特性再生人体内受损的细胞和组织,或者在用健康细胞替代受损细胞的情况下,将外源干细胞输送到患者体内。在生物系统中,干细胞是负责不同器官和组织再生的组织单位。在人体内,干细胞根据其分化潜能可分为五种类型:全能干细胞、多能干细胞、专能干细胞、寡能干细胞和单能干细胞。世界上第一个有记录的用于治疗白血病的同种异体造血干细胞 (HSC) 移植于1957年完成。由于当时骨髓移植还不为人所知,因此该研究中的所有6名患者均死亡,只有两名患者表现出短暂植入的证据,这一结果表明移植失败了。然而,在接下来的两年里,研究人员发现健康同卵双胞胎的骨髓移植可以用来治疗白血病。此后,经过数十年的快速发展,SCT领域取得了许多重大进展,例如胚胎干细胞和诱导性多能干细胞的发现及其在不同疾病中的应用,这不仅提高了研究者和患者对SCT的信心,也推动了SCT市场的快速发展(图1)。图1:干细胞疗法(SCT)几十年来取得的重要研究进展临床上,人体内用于治疗的干细胞有很多种,可分为以下四种类型:ESC、VSEL、iPSC和ASC。这些细胞在SCT中具有独特的特征(表1)。为了加快SCT的临床应用,在前期动物实验安全性数据的基础上,世界各国开展了广泛的SCT临床试验。截至2022年12月,已有超过9400项干细胞相关试验在临床试验注册网站(http://www.clinicaltrials.gov)注册,其中大部分主要集中在北美、欧洲和东亚。尽管并非所有注册的临床试验都已进行或有结果,但这些数据仍然反映出SCT对世界各地研究人员的强烈吸引力(图2)。图2:截至2022年,在ClinicalTrials.gov上注册的SCT临床试验数量尽管SCT尚未真正实现大规模临床应用,但其在多个疾病系统的临床研究已有报道和统计。据干细胞临床研究数据库(DB)统计,目前SCT的临床试验有84个,涉及心血管、骨骼、神经、免疫、胃肠道、肺、泌尿、眼科等。其中,SCT临床试验文章大多集中在前五类,尤其是心血管系统疾病的研究数量最多(图3)。图3:截至2022年,StemCreDB上不同类别疾病的干细胞临床试验文章数量此外,从1976年至今,这些临床试验呈增加趋势。需要说明的是,2020年至2022年这3年间,SCT临床试验文章数虽然没有前四年文章数总和高,但相差并不大(图4)。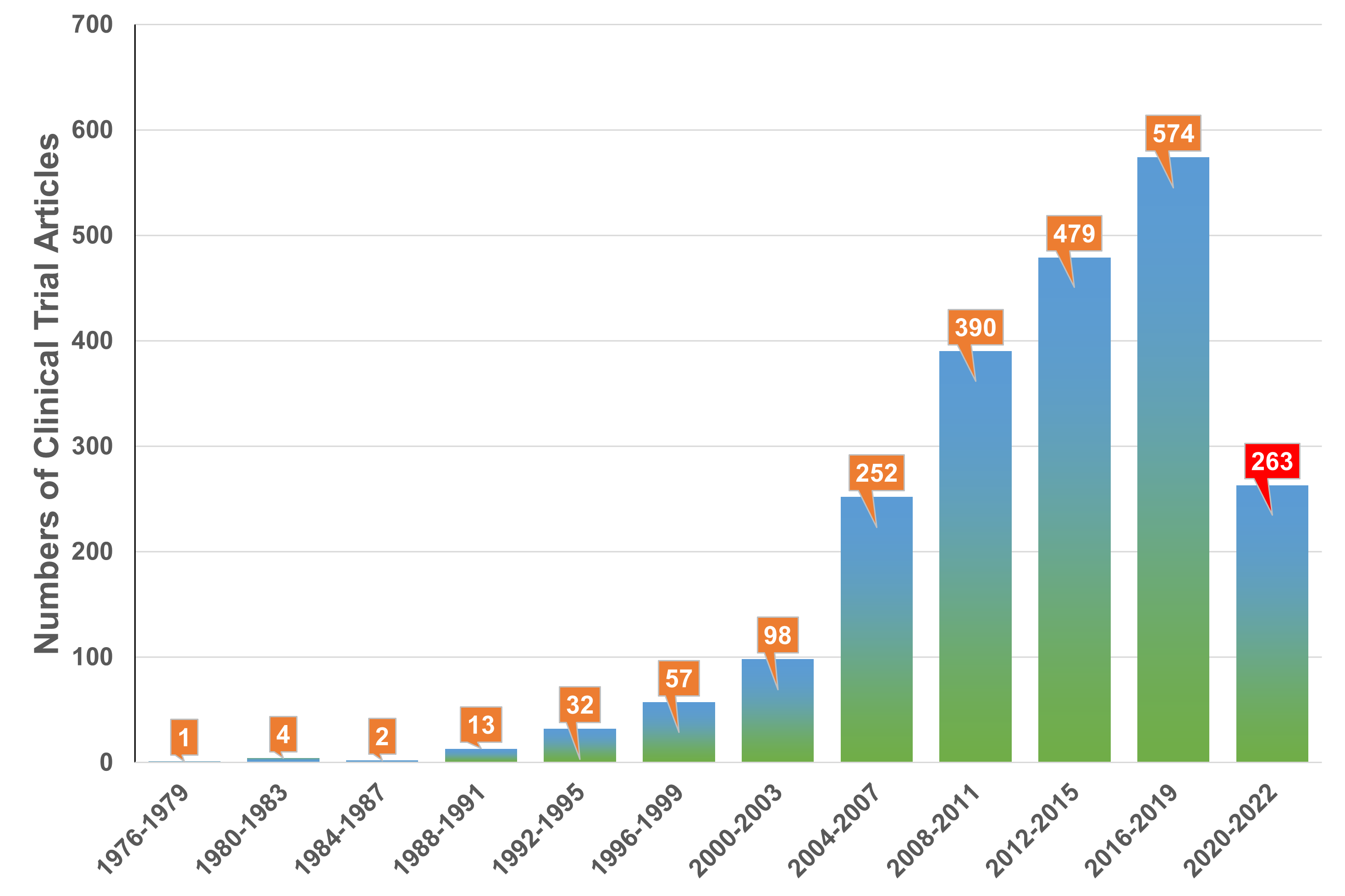
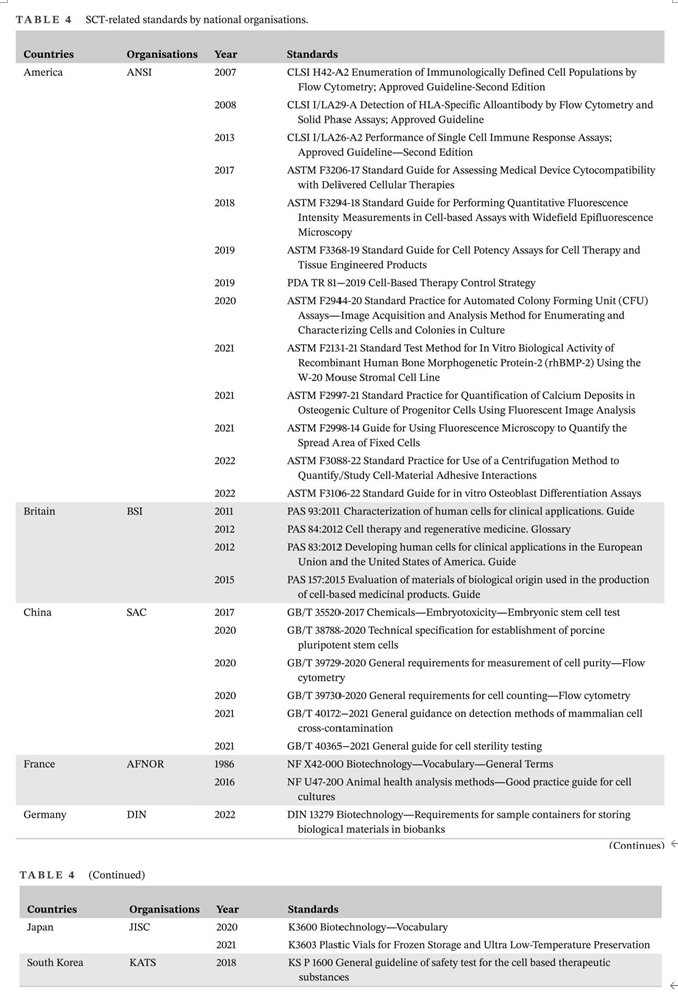
图4:截至2022年,StemCreDB上不同年份的干细胞临床试验文章数量考虑到免疫排斥、伦理障碍和治疗费用等多重因素,移植细胞以自体细胞为主。此外,大部分试验仍处于探索性研究阶段,Ⅲ期及以上临床试验数量相对较少(图5)。因此,SCT距离全面实现大规模临床应用还有一定距离。图5:截至2022年,StemCreDB上不同研究阶段的干细胞临床试验文章数量稳健的临床试验推动了市场的显着增长,SCT的市场规模增长迅速。根据Global Market Insight发布的2021年SCT市场报告,2020年全球SCT市场规模预计为89亿美元,其中北美市场份额最大,为41.5%,这或受益于政府的大力支持。报告还预测,随着技术的进步和对生物制剂关注度的提高,2021年至2027年SCT的市场规模将以超过10.6%的复合年增长率 (CAGR) 增长。然而, SCT的发展也面临着限制因素。例如,PSC的伦理问题及其固有特性(包括致瘤性和免疫原性)限制了其使用。此外,MSCs的稳定性、分化和运输的不一致,以及临床前和临床研究之间的差异,给SCT的应用带来了挑战。所有这些挑战都可能对SCT的市场发展产生不利影响。目前,国际标准化工作主要由ISO进行。参与制定SCT相关标准的技术委员会(TC)主要是ISO/TC 276生物技术。ISO/TC 276发布了26项标准,其中12项与细胞治疗有关。这些标准主要包括四个方面:第一是规定了hBMSC、人和小鼠PSC以及hUCMSCs的生物库的要求;第二是规定了对细胞的一般要求;第三是规定了用于制造治疗用细胞的设备系统和辅助材料的基本要求和一般考虑因素。第四是规定了生物样本库中所有生物材料处理方法验证和验证的一般要求。ISO/TC 276生物技术正在制定的15个标准中,有5个标准与SCT相关。这些标准不仅包括了对特定类型干细胞的要求,而且还涵盖了细胞的一般要求,包括细胞形态分析、活力分析和包装设计,以及干细胞数据的数据互操作性等(表2)。为了及时有效地补充和更新相关SCT标准,已经成立了一些国际组织来协助标准的制定。血液和生物治疗促进协会(AABB)以前称为美国血库协会,为采购、加工、储存和/或分销细胞治疗产品的机构制定标准并对其进行认证;细胞治疗认证基金会(FACT)是由国际细胞与基因治疗学会(ISCT)和美国移植与细胞治疗学会(ASTCT)共同创立,其制定的标准主要包括造血细胞治疗标准、脐带血库标准和通用标准;国际细胞与基因治疗学会(ISCT)不仅参与了FACT标准的制定,还独立制定了SCT相关标准,包括MSCs的最低标准和免疫学表征;国际干细胞研究学会(ISSCR)作为从事干细胞研究的重要国际专业组织,自2006年以来已发布了四份关于干细胞研究和临床转化的指南,促进了干细胞领域的科学探究和伦理考虑。在欧洲,欧盟委员会通过建立欧洲药品和保健质量理事会 (EDQM) 制定与细胞移植相关的指导和标准。EDQM出版的欧洲药典 (Ph. Eur.) 包含多项细胞治疗的质量控制标准,例如细胞计数和活力测定、细胞制剂的微生物学检查以及细胞治疗产品原材料的生产。为了确保人体应用的组织和细胞的质量和安全,EDQM也发布了相应的指南。最新指南不仅包含适用于参与组织和细胞捐赠、采购、检测、加工、保存、储存和分配的所有组织机构和组织的一般要求,还包含针对各种组织和细胞类型的具体指南和要求。然而,欧洲制定的SCT相关标准并不能完全适用于其他国家或地区。为了实现更广泛地区的药物开发和监管标准的统一,欧洲、日本和美国的组织代表讨论并成立了国际协调理事会(ICH)。所有ICH指南的主题分为四类:质量指南、安全指南、功效指南和多学科指南。他们将确保安全、有效和高质量药物的开发和注册(表3)。世界各国都在以单一标准追求全球自由贸易,但在当前形势下实现这一目标确实不容易。因此,各国国家标准机构在采用ISO标准的基础上,也会根据自己的实际需要对国际标准进行调整和补充,以建立国家标准。例如,欧洲的英国标准协会(BSI)、德国标准化研究所(DIN)和法国正常化协会(AFNOR),亚洲的日本工业标准委员会 (JISC) 、韩国技术和标准局 (KATS)和中国标准化管理委员会(SAC)。不同于其他国家,美国国家标准协会(ANSI)是ISO在美国的唯一代表,但它不是标准制定组织。美国国家标准是由 ANSI 通过认可标准开发组织 (SDO) 的程序并批准其文件的过程来制定的。制定SCT相关标准的SDO主要包括美国测试与材料协会(ASTM)、临床和实验室标准协会(CLSI)和肠外药物协会(PDA)。除国家标准外,各国还可能有团体标准、行业标准和地方标准,这些标准将在特定领域补充国家标准。在世界各国的努力下,SCT的标准化体系日益完善(表4)在再生医学新时代,SCT的出现代表了生物医学的突破性发展。经过几十年的发展,SCT在临床研究和市场规模方面取得了令人瞩目的成就。SCT行业的健康快速发展离不开相应标准所发挥的积极引导作用。干细胞疗法标准包括三个层次:ISO标准、区域组织标准和国家标准。这些制定的标准有效协调了不同国家和地区之间的药物研发和监管标准,避免了标准活动的重叠,提高了干细胞相关产品的应用效率。然而,SCT的标准化仍处于起步阶段。标准发展方向分散,尚缺乏覆盖SCT各个方面的完整标准化体系,这对SCT的临床应用产生了负面影响。随着干细胞相关研究的不断深入和逐渐成熟,SCT标准化体系的建设也不断完善。标准化和质量控制可以确保SCT的安全性和有效性。相信在不久的将来,SCT将真正实现从实验室研究到大规模临床的转变。Standardisation is the key to the sustained, rapid and healthy development of stem cell-based therapy, Clin Transl Med. 2024 Apr;14(4):e1646. doi: 10.1002/ctm2.1646.外泌体资讯网 CLIN TRANSL MED|大连医科大学附属第一医院刘晶教授团队:标准化是干细胞治疗持续、快速、健康发展的关键所在