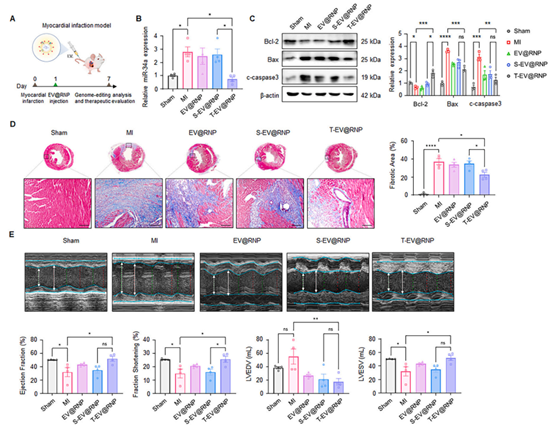
心肌梗死(MI)是全球发病率和死亡率的主要原因。尽管CRISPR/Cas9基因编辑具有巨大的基因操作潜力,但其临床应用受限于缺乏高效的心脏靶向药物递送系统。近日,J Control Release杂志发表一篇文章,报道开发了与心脏靶向肽(T)结合的装载CRISPR-Cas9核糖核蛋白(RNP)的细胞外囊泡(EVs),用于精确的心脏特异性基因组编辑。
心肌梗死(MI)是一种常见且潜在致命的疾病,每年约有150,000例隐匿性心肌梗死发生。心肌梗死后的心脏损伤会导致心肌细胞凋亡和随后的心肌纤维化。除了心肌细胞死亡外,心肌梗死还会引起严重的炎症,进一步损害心脏组织。尽管通过外科手术和药物治疗(包括阿司匹林或抗血小板治疗)可以管理心肌梗死,但显然需要开发新的方法来改善临床结果。使用成簇的规律间隔短回文重复序列(CRISPR)相关蛋白9(Cas9)进行基因组编辑,已经成为一种有前景的治疗性基因组编辑工具。CRISPR/Cas9的递送可以采用不同的形式,如质粒DNA、mRNA和核糖核蛋白(RNP)复合物。最简单的策略是由Cas9蛋白和单导向RNA(sgRNA)组成的RNP复合物,这无需细胞内的转录和翻译,从而能够实现快速编辑并且免疫反应较低。尽管有这些优势,RNP的高效递送仍然具有挑战性,因为缺乏体内递送系统,这限制了这种方法的临床可行性。首个使用脂质纳米颗粒(LNPs)进行CRISPR/Cas9体内基因编辑治疗的临床试验于2021年应用于转甲状腺素蛋白淀粉样变性。目前,仍需进一步研究以优化针对心血管疾病的CRISPR/Cas9技术。随着CRISPR/Cas9 RNP治疗递送策略的发展,显然需要一种安全且高效的递送方法。非病毒纳米颗粒代表了有前景的替代递送模式,包括LNPs、金纳米颗粒和聚合物纳米颗粒。为了提高这些替代模式的疗效,需要能够有效瞬时体内递送CRISPR/Cas9 RNPs的载体。细胞外囊泡(EVs),特别是外泌体,是直径为30-150纳米的纳米级囊泡,通过运输蛋白质、脂质和核酸介导细胞间通讯。体液中循环的EVs相对容易通过微创采样获得,在循环中相对稳定,并且保护其载荷不被酶降解。此外,循环EVs的非免疫原性使其在体内治疗应用中具有优势。总而言之,EVs是具有显著稳定性和良好安全性的天然纳米载体。事实上,EVs可以用作RNP递送载体,以实现高效的基于CRISPR的基因组编辑。尽管有这些优势,EVs在体内特定器官的靶向递送仍需要进一步研究。克服当前递送系统限制的一种有前景的方法是对递送工具进行表面修饰,以靶向特定器官。可以对EVs进行工程改造,使其表达特定的表面蛋白或肽,从而实现对细胞类型和组织的靶向。这种对EV膜的修饰可以用于伪装和递送RNP,通过配体赋予的人工模块功能增强Cas9 RNP的递送,使其能够在体内靶向所需细胞。最近,有几项研究探索了使用工程化EVs递送Cas9 RNP治疗肝病和肿瘤。尽管在EV介导的RNP递送用于体内基因治疗方面取得了进展,但将CRISPR/Cas9基因编辑技术应用于心脏疾病仍然具有挑战性。在心脏疾病的背景下,靶向治疗心脏是至关重要的,因为局部递送治疗剂可能会改善治疗效果。心脏靶向肽(T肽)是一种设计用于特异性结合心肌细胞的穿透细胞肽。在之前的研究中,通过在细胞膜上表达T肽对细胞进行了基因改造,发现来自含有T肽的细胞系的外泌体增强了对心脏的特异性递送。使用T肽,可以对EVs进行工程改造,使其特异性结合心肌细胞的表面,从而实现高效且选择性地递送心脏治疗剂。因此,为了提高Cas9 RNP复合物的体内递送效率,该研究探索了使用T肽修饰的、载有RNP的EVs,以实现更好的靶向递送。EVs可以通过工程改造表达特定的表面蛋白或肽,从而实现对细胞类型和组织的靶向。这种对EV膜的修饰可以用于伪装和递送RNP,通过配体赋予的人工模块功能增强Cas9 RNP的递送,使其能够在体内靶向所需的细胞。该研究旨在开发装载CRISPR-Cas9 RNP的心脏靶向EV(T-EV@RNP),用于心脏特异性基因组编辑。含有Cas9和靶向miR-34a(一种与心肌梗死相关的分子靶点)的单导向RNA的RNP复合物被装载到EVs中(EV@RNP)。在评估了装载RNP的EV(EV@RNP)对过氧化氢(H2O2)诱导的凋亡的体外效应以模拟缺血性损伤后,使用点击化学将T肽与EV@RNP结合,以改善心脏靶向性。接着,评估了T-EV@RNP介导的miR-34a基因组编辑对心肌梗死的体内治疗效果。通过Bcl-2/Bax/caspase-3信号通路评估了EV@RNP在调节心肌梗死诱导的心肌细胞凋亡中的抗凋亡作用。因此,以心脏为靶向的EV介导的CRISPR-Cas9 RNP可能为推进心脏特异性基因治疗提供了纳米平台。该研究的体外和体内试验表明,通过心脏靶向EVs递送的RNP进行基因编辑可能通过减轻凋亡发挥心脏保护作用,从而改善由心肌梗死引起的损伤。然而,该研究的一个局限是缺乏进一步验证体内基因编辑效率的调查。尽管存在这一局限性,该研究展示了心脏特异性EV介导基因编辑作为心肌梗死治疗的先进治疗方法的潜力。总之,这是首次提出通过心脏靶向EVs递送RNP的基因编辑递送策略,作为针对心血管疾病的体内特异性基因治疗的有前景的治疗纳米平台。Mun D, Kang JY, Kim H, Yun N, Joung B. Small extracellular vesicle-mediated CRISPR-Cas9 RNP delivery for cardiac-specific genome editing. J Control Release. 2024 May 17;370:798-810. doi: 10.1016/j.jconrel.2024.05.023. PMID: 38754633.外泌体资讯网 【J Control Release】细胞外囊泡介导CRISPR/Cas9 RNP递送用于心脏特异性基因组编辑