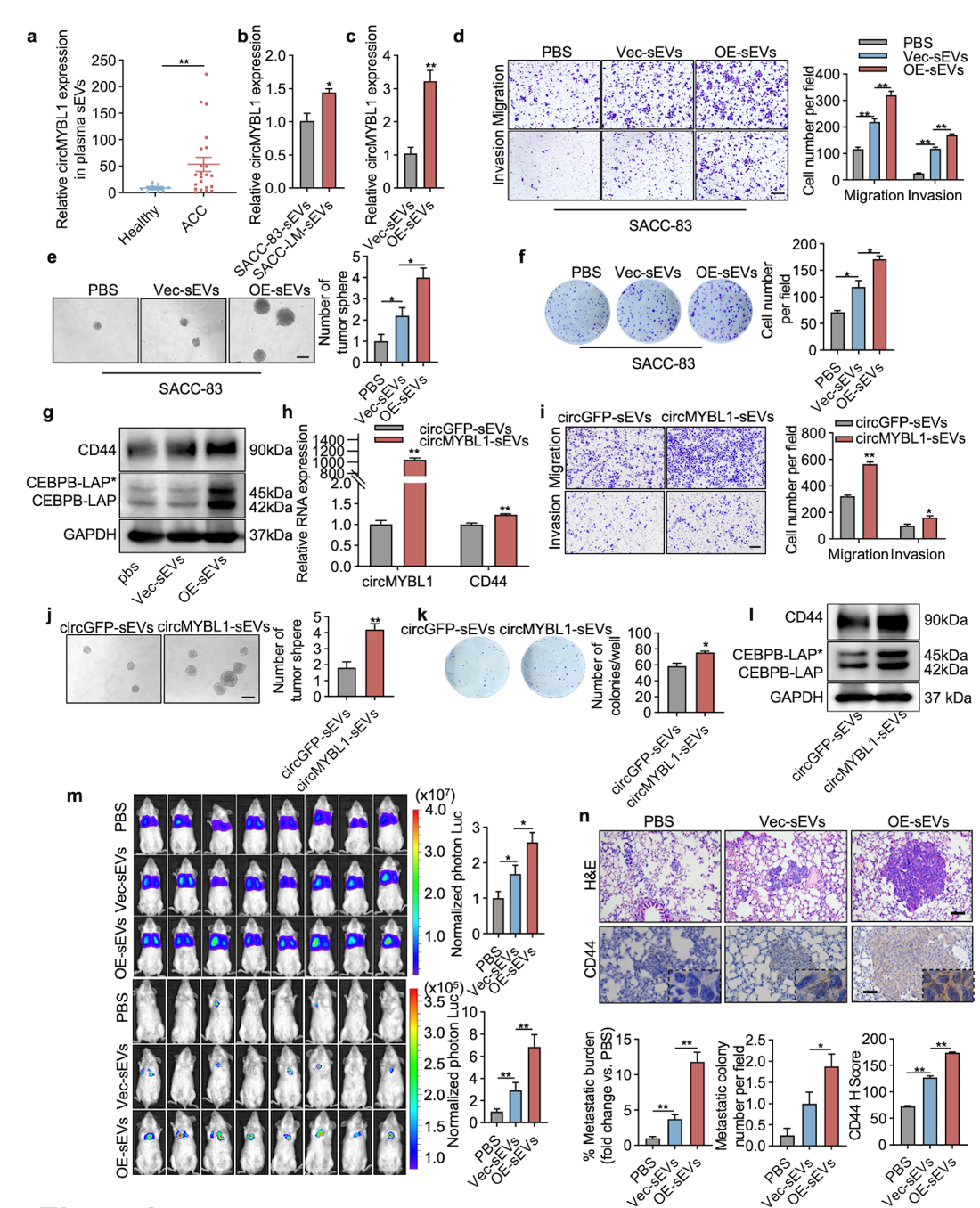
涎腺腺样囊性癌(SACC)是头颈部恶性肿瘤中远处转移率最高的一种,其远处转移率可达22%~52%。发生远处转移的SACC患者的生存期显著低于未发生转移的患者,而且远处转移多至肺组织。然而,尽管SACC的临床和病理特征已经被广泛研究,其发病机制,特别是肺转移的分子基础,仍然未完全明确。目前,尚无有效的化疗或靶向药物能够治疗这种难治性肿瘤或预防其肺转移。研究发现,MYB和MYBL1基因的融合和过表达与SACC的发生和进展密切相关。尽管MYB-NFIB融合事件在SACC中已被广泛研究,但MYBL1如何通过调节下游靶基因来促进SACC的侵袭和转移,仍有许多未知之处。作为一类特殊的非编码RNA,circRNA相较于线性RNA更能耐受外切酶的消化,且在多种癌症的发生和进展中发挥重要作用。尽管circRNA的研究取得了一定进展,但针对MYBL1基因衍生的circRNA的研究仍处于起步阶段,特别是在腺样囊性癌中的具体功能和机制研究尚未深入开展。小细胞外囊泡(sEVs)是一类直径小于200 nm的细胞外囊泡,能够携带包括蛋白质、脂质、DNA和RNA在内的多种生物分子。它们通过细胞间的交流,影响肿瘤的微环境和转移。研究表明,sEVs在肿瘤微环境的调节中发挥重要作用,本研究发现circMYBL1在SACC患者血浆sEVs中高表达,因此探究circMYBL1在SACC来源的sEVs中的作用及机制是很有意义的。2024年4月24日,北京大学口腔医院葛兮源研究团队揭示sEVs中的circMYBL1在SACC肺转移中的功能及其作用机制,相关论文“Extracellular vesicles containing circMYBL1 induce CD44 in adenoid cystic carcinoma cells and pulmonary endothelial cells to promote lung metastasis”在Cancer Research上发表。
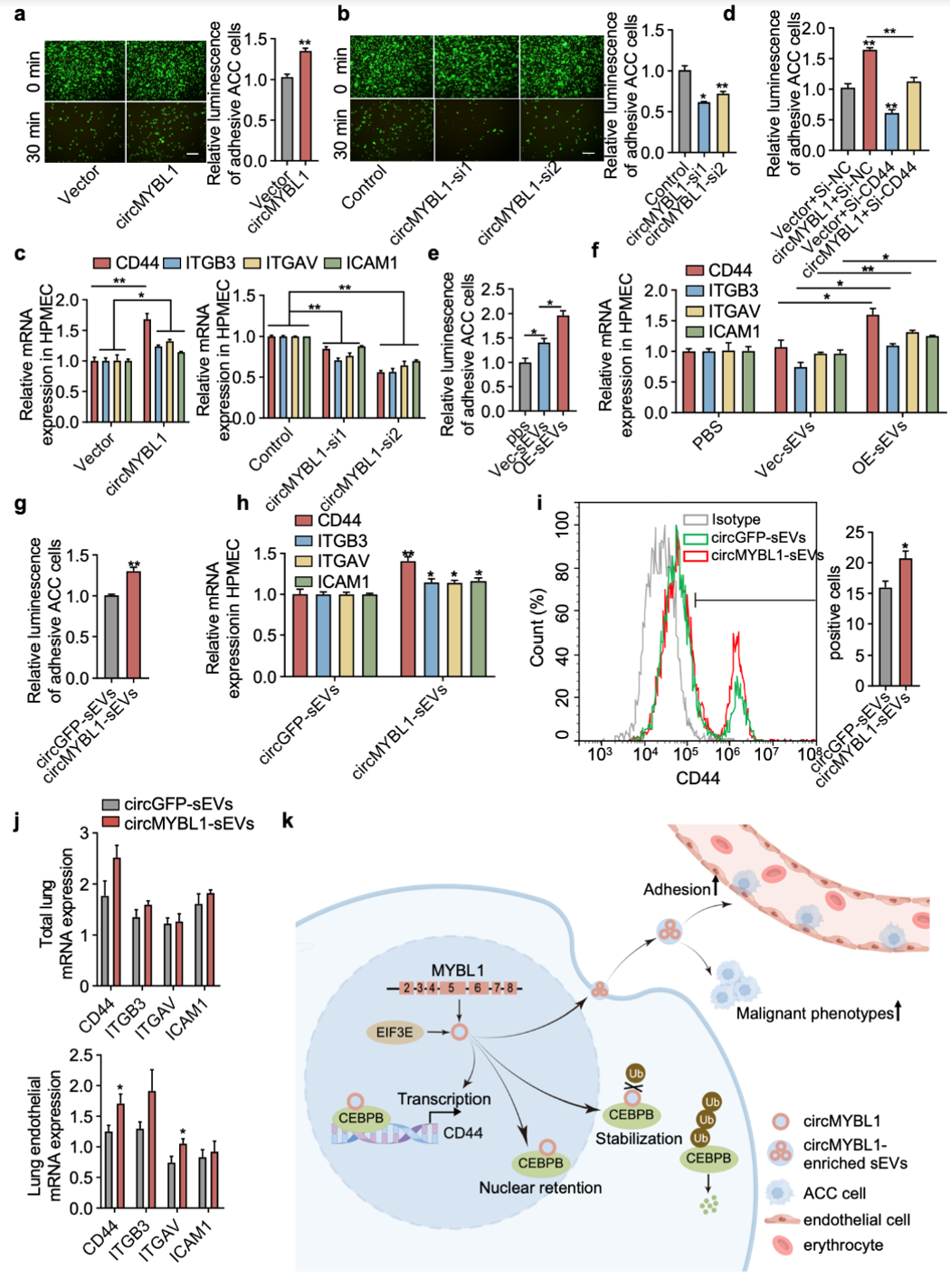
在这项研究中,研究人员通过组织和细胞芯片筛选,结合circBase数据库中MYBL1来源的circRNAs,筛选出名为circMYBL1的环状RNA。研究表明,circMYBL1在SACC细胞和组织中高表达,其水平与SACC的肺转移及患者预后密切相关。进一步实验显示,circMYBL1在体外促进SACC的恶性表型,在体内则促进SACC的肺转移。机制研究发现,circMYBL1通过与CCAAT增强子结合蛋白β(CEBPB)形成环状RNA-蛋白复合物,抑制CEBPB的泛素介导降解,促进其向细胞核转位。在细胞核内,circMYBL1增强了CEBPB与CD44启动子区域的结合,从而增加CD44的转录活性。此外,通过提取不同SACC细胞及SACC患者和正常人血浆样本中的sEVs,研究人员发现circMYBL1在SACC患者血浆和细胞上清中的sEVs中富集。过表达circMYBL1的sEVs处理SACC细胞后,显著促进了SACC细胞的恶性表型及其与HPMECs的黏附。进一步体内实验显示,富含circMYBL1的sEVs增加循环SACC细胞的肺内停滞以及远处肺转移(图1)。作者还通过尾静脉注射转染circMYBL1的sEVs,利用流式细胞术和RT-qPCR检测发现,这些sEVs增加了小鼠肺血管内皮细胞中CD44和黏附分子的表达,促进了肿瘤细胞在肺部的定植和转移(图2)。因此本研究揭示circMYBL1在SACC中的高表达及其在sEVs中的富集通过多种机制促进了SACC的恶性进展和肺转移。图1:富含circMYBL1的sEVs中促进SACC细胞恶性表型、肺内停滞和长期肺转移图2:富含circMYBL1的sEVs促进肺血管内皮细胞粘附肿瘤细胞Extracellular vesicles containing circMYBL1 induce CD44 in adenoid cystic carcinoma cells and pulmonary endothelial cells to promote lung metastasis.Cancer research, https://doi.org/10.1158/0008-5472.CAN-23-3508外泌体资讯网 Cancer Research|北京大学口腔医院葛兮源研究团队揭示小细胞外囊泡中的circMYBL1促进SACC肺转移的新机制