细胞外囊泡(EVs)是由细胞分泌的具有磷脂双分子层结构的自然囊泡,可以在细胞之间传递货物,是一种有前景的生物活性纳米材料。然而,由于EVs复杂异质的生物特性,目前仍缺乏一种稳健方法实现EVs操纵和高效递送。
近日,中国科学院宁波材料技术与工程研究所郑建萍研究员、王凯喆副研究员和上海大学李江教授合作,在JACS Au杂志发表了题目为“Extracellular Vesicle Spherical Nucleic Acids”的研究成果(https://doi.org/10.1021/jacsau.4c00338),开发了一类全新的细胞外囊泡球形核酸(EV-SNA)纳米结构,EV-SNA具有可扩展性、可编程性和高效细胞递送的特性。
(1)EV-SNA构建及结构表征
如图2所示,EV-SNA可由天然EVs和胆固醇修饰的ssDNA孵育简单震荡共组装而成。通过调节chol-DNA浓度,每个囊泡平均插入的DNA可从约1320条增加到4660条。此外,EV-SNA在室温PBS储存30天后,平均粒径及囊泡结构均无显著变化,表现出极强的稳定性。

(2)EV-SNA的可编程操控
EV-SNA纳米结构为天然EVs复杂异质的生物界面引入了精准、可编程的核酸外壳,从而为EVs提供了无与伦比的可控性。为了展示EV-SNA的可操纵性,作者通过DNA编程设计,构建了一种AND逻辑门控制的EV-SNA组装(图3)。
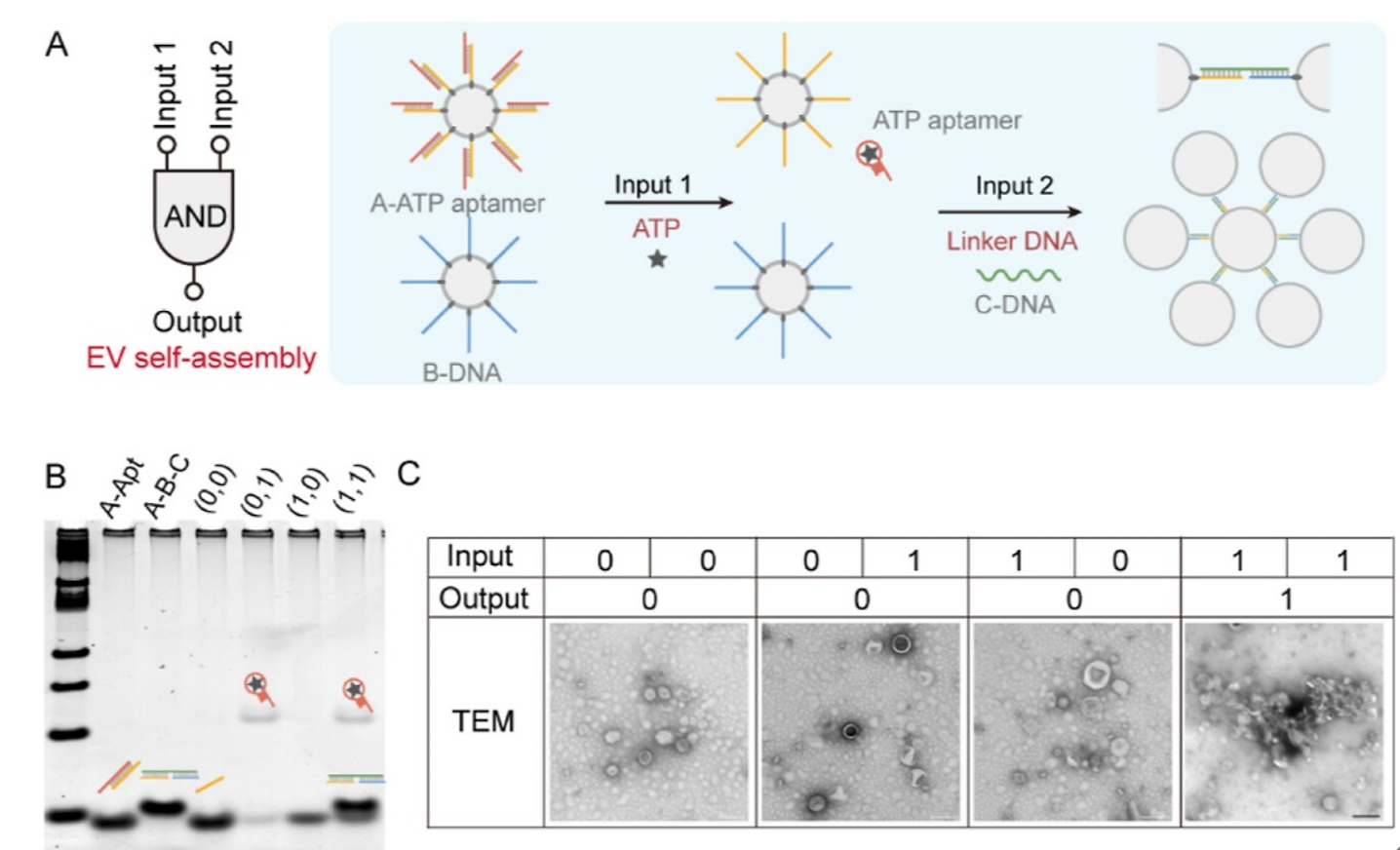
(3)结构依赖的EV-SNA高效细胞递送
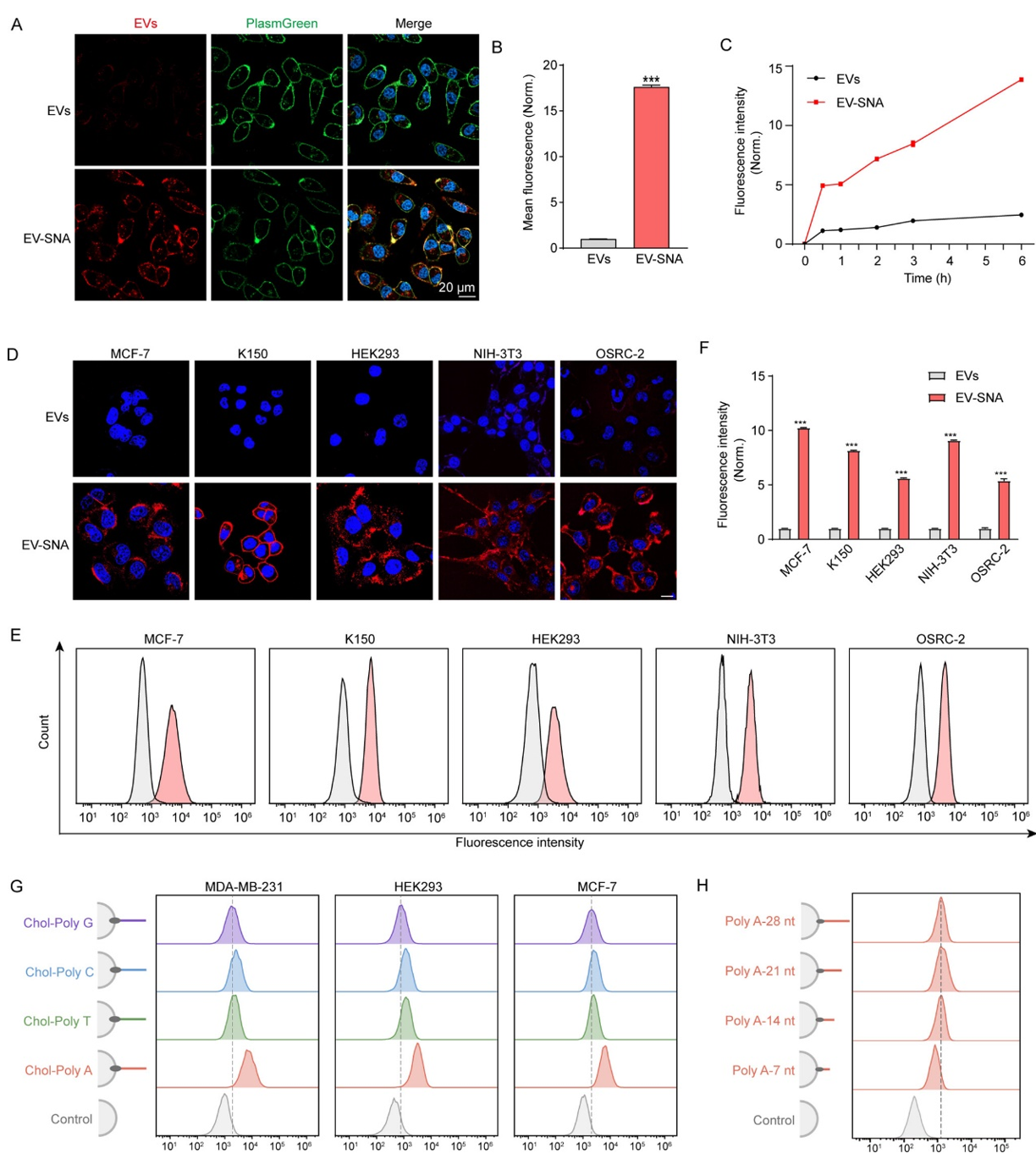
研究发现,EV-SNA无需转染剂高效地进入细胞。相比于天然EVs,EV-SNA进入细胞的效率提高了近10-20倍,且可在各种类型细胞中高效递送。此外,作者研究了DNA密度、序列、长度对EV-SNA高效细胞摄取的影响,解析了EV-SNA“核-壳”组分结构与细胞高效递送的构效关系,实现EV-SNA的可编程高效递送。
(4)基于多种生物来源的EVs构建EV-SNA
几乎所有生物体都可以释放EVs,基于此,作者构建了不同生物来源的EV-SNA纳米结构。结果表明,植物以及细菌来源的EVs构建的EV-SNA纳米结构,同样可以高效细胞摄取,证明了可以基于多种内源性EVs构建具有高效细胞递送能力的EV-SNA纳米结构(图5)。

(5)EV-SNA 递送功能性核酸和EVs
作为概念验证,作者利用EV-SNA纳米结构递送功能性核酸以及内源性EVs。
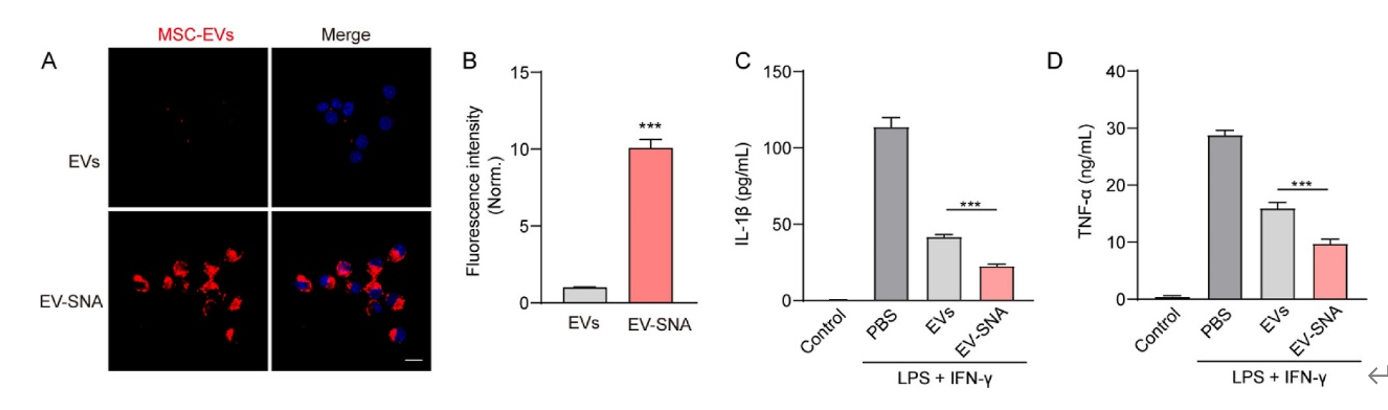
首先,在外源性核酸递送上,作者向难以转染的原代人源间充质干细胞(MSCs)递送反义寡核苷酸(ASO)。与脂质体球形核酸(Lipo-SNA)相比,通过内源性EVs构建的EV-SNA纳米结构在难以转染的原代MSCs细胞中具有更好的生物相容性和更高的递送效率(图6)。
在功能性EVs递送上,作者利用EV-SNA纳米结构递送MSC-EVs进行免疫调节。与天然MSC-EVs处理组相比,EV-SNA处理组对LPS和INF-γ诱导的RAW264.7(巨噬细胞系)炎症细胞模型表现出更好的炎症抑制效果,对TNF-α和IL-1β释放的抑制作用更为明显(图7)。

这项研究构建了一类EV-SNA纳米结构,这种结构可以简单快速的组装获得。EV-SNA具有以下优点:(1)高度模块化,EV-SNA组件具有高度模块化和可替换性,可基于广泛生物来源的天然EVs内核和核酸外壳构建材料库,以满足不同需求的EV-SNA应用;(2)高效的细胞递送,在难以转染的细胞中表现出比脂质体更优越的递送特性,可作为一种全新的治疗平台递送内源性或外源性货物;(3)灵活的可扩展性,理论上不同的官能团或药物分子都可通过碱基互补配对方式装载至EV-SNA表面或封装在囊泡腔内以实现高效递送。
中国科学院大学硕士研究生陈浩和温州医科大学硕士研究生丁桥娇为文章的共同第一作者。
外泌体资讯网 JACS Au: 中国科学院宁波材料技术与工程研究所郑建萍研究员、王凯喆副研究员和上海大学李江教授:细胞外囊泡球形核酸





