外伤、感染等因素导致的牙缺损和缺失是普遍存在的口腔健康问题,原位再生结构有序和功能健全的牙组织具有极大挑战。空军军医大学口腔医院金岩教授、轩昆教授课题组长期致力基于干细胞移植的牙再生基础和临床研究,前期依据发育期间充质凝聚原理创建了干细胞聚合体(Cell aggregates, CA)技术,并且利用乳牙牙髓干细胞(Stem cells from human exfoliated deciduous teeth, SHED)聚合体移植成功率先在临床实现年轻恒牙外伤后全牙髓再生和牙髓-牙周联合再生支持的完全脱位牙延期再植,相关成果于先后发表于Science Translational Medicine(IF=18.0)、Biomaterials(IF=15.3)等杂志,并陆续在Physiological Reviews(IF=46.5)、Aggregates(IF=18.8)等期刊发表专题论述。然而,植入的干细胞聚合体与宿主的交互作用模式尚不清楚,聚合体与宿主协同实现牙组织再生的机制仍未阐明。
近日,金岩教授、轩昆教授领衔课题组在国际纳米研究重要期刊Small(IF=13.3)发表了题为“Odontogenesis-Empowered Extracellular Vesicles Safeguard Donor-Recipient Stem Cell Interplay to Support Tooth Regeneration”的论文(2024 Jun 11:e2400260),发现植入干细胞聚合体促进全脱位牙再植后组织再生的过程中宿主Gli1+干细胞发挥了关键作用。基于课题组前期对聚合体来源细胞外囊泡(Extracellular vesicles, EVs)调控牙髓再生功能的探索,该研究进一步发现聚合体形成后可以分泌具有发育调控潜能的EVs(CA-EVs),由此动员宿主Gli1+干细胞功能而促进牙周组织再生和脱位牙再植成活。该研究结果揭示了牙组织再生过程中植入干细胞与宿主干细胞的交互作用模式,为临床牙组织再生治疗提供了理论基础和实验依据。
Gli1+细胞与间充质干细胞(Mesenchymal stem cells, MSCs)具有密切关联,在牙生长发育、损伤修复和组织改建过程中发挥了关键作用,然而其在植入干细胞诱导组织再生过程中的角色尚未深入探讨。该研究首先运用特异性标记宿主Gli1+细胞的转基因小鼠构建聚合体主导的脱位牙再植后牙组织再生模型,发现干细胞聚合体促进牙周组织再生过程中宿主Gli1+细胞数量显著增加、动员进入牙再植后牙周区域,并发生成骨、成牙骨质分化;而后运用特异性敲除宿主Gli1+细胞的转基因小鼠,发现敲除宿主Gli1+细胞后干细胞聚合体的牙组织再生效果显著降低。进一步探索牙组织再生过程中干细胞聚合体对宿主Gli1+细胞的调控方式,发现运用GW4869抑制EVs分泌后干细胞聚合体的牙组织再生功能受抑制,同时Gli1+细胞的活化明显减弱。对CA-EVs进行分析发现其中包含调控Gli1+细胞的发育相关蛋白分子,在体外将CA-EVs与Gli1+细胞共培养可增强Gli1+细胞的增殖和分化功能。值得注意的是,将CA-EVs运用于小鼠全脱位牙再植模型,发现CA-EVs可以诱导宿主Gli1+细胞活化并促进牙组织再生。该研究揭示了干细胞聚合体通过具有凝聚诱导的发育来源特性和再生调控功能的EVs激活宿主Gli1+细胞再生全脱位牙牙周组织的新作用模式,并为全脱位牙齿再植提供不依赖外源细胞的潜在新治疗策略。
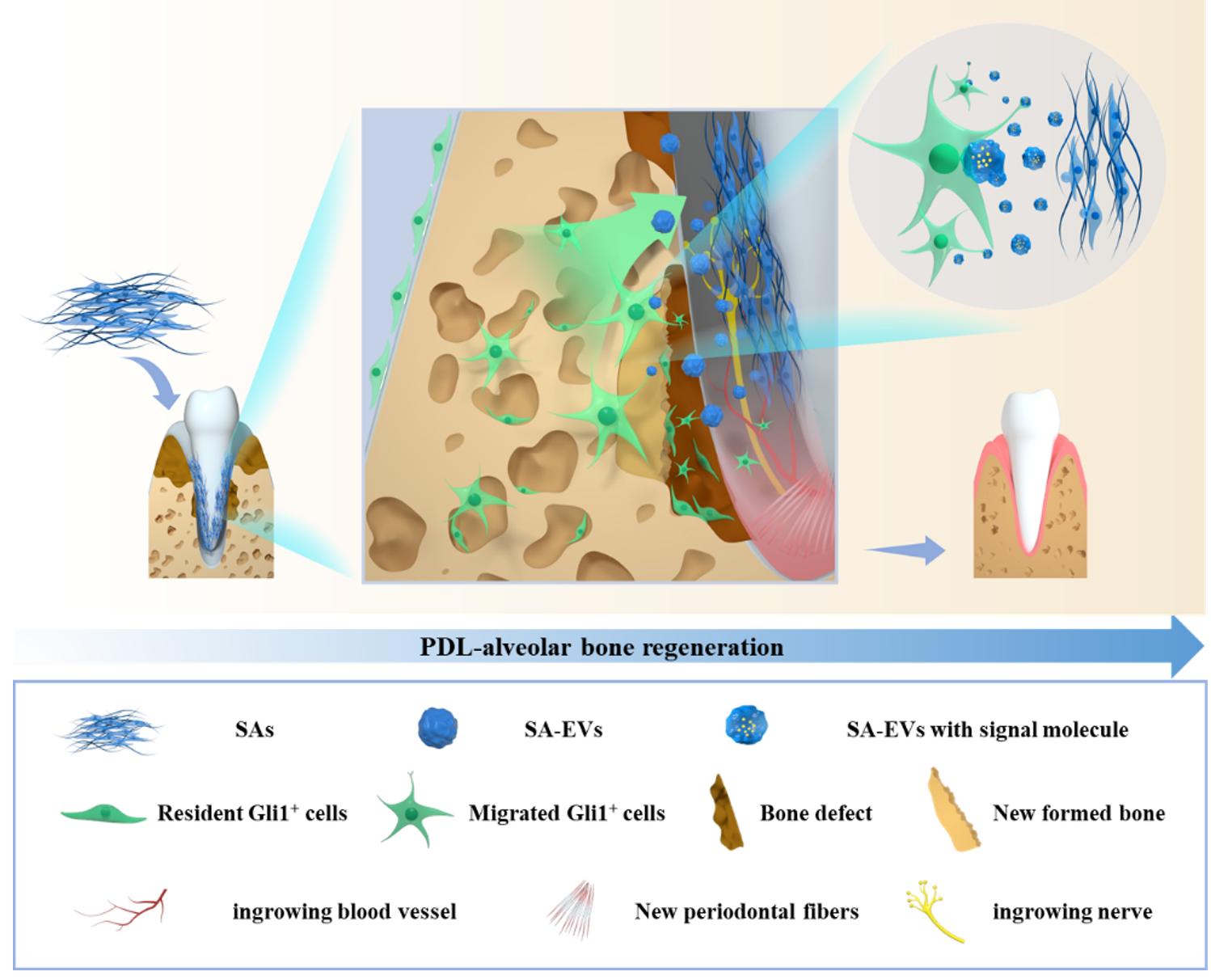
研究发现示意图
在该研究中,空军军医大学轩昆教授、金岩教授为论文的共同通讯作者,博士研究生黄晓瑶、副主任医师隋秉东、讲师刘安琪为论文的共同第一作者。论文致谢科技部重点研发计划项目(2022YFA1104400)、国家自然科学基金项目(82370949、81930025、82371020、82301028、82100992、82100969)、陕西省青年科技新星项目(2023KJXX-027、2024ZC-KJXX-122)和中国博士后科学基金(BX20230485)的支持。课题组团队在相关领域获得国家科技进步一等奖1项,省部级科学技术一等奖5项,2次入选中国十大生物医学科学进展。团队长期欢迎研究生报考和优秀博士后、科研助理加入团队,有意向可发送简历至隋秉东老师(bingdong1221@163.com)。
参考文献
Odontogenesis-Empowered Extracellular Vesicles Safeguard Donor-Recipient Stem Cell Interplay to Support Tooth Regeneration. Small, 2024: e2400260.





