脓毒症是宿主对入侵病原体的一种失调反应。肺脏通常是脓毒症患者最先受损的器官。急性呼吸窘迫综合征(ARDS)是导致脓毒症患者死亡的重要因素。虽然 ARDS 的治疗取得了进展,但脓毒症引起ARDS后死亡率仍然很高。细胞外囊泡(EVs)是由各种类型细胞分泌的磷脂双层膜囊泡结构。内含物包括核酸(miRNA、lncRNA、cirRNA)、蛋白质和脂质。不同EVs-miRNA 通过不同机制在ARDS中发挥保护或者损伤作用。多组学数据包括基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学和免疫组学,单细胞转录组学经常与其他组学方法相结合,研究基因表达与表型多样性之间的相关性。如何通过多组学技术帮助寻找更好的EVs-miRNA作为治疗靶点仍需要进一步探索。
近日,南方医科大学李旭/孟莹教授团队在国际知名杂志Journal of Nanobiotechnology(IF=10.6 中科院一区top)上发表题为“Macrophage Biomimetic Nanoparticle-Targeted Functional Extracellular Vesicle Micro-RNAs Revealed via Multiomics Analysis Alleviate Sepsis-Induced Acute Lung Injury”的论文(2024 Jun 23;22(1):362.)。作者通过脓毒症患者血清 EV(sEV)的 miRNA 表达谱联合单细胞 RNA(scRNA)测序筛选了MiR-125a-5p及miR-221-3p可作为脓毒症肺损伤的治疗靶点,并通过巨噬细胞膜(MM)构建了含有miRNA mimic或inhibitor的纳米囊泡经递送至小鼠肺脏用以缓解脓毒症引起的急性肺损伤。王国振博士为论文第一作者,李旭/孟莹教授是该论文通讯作者。
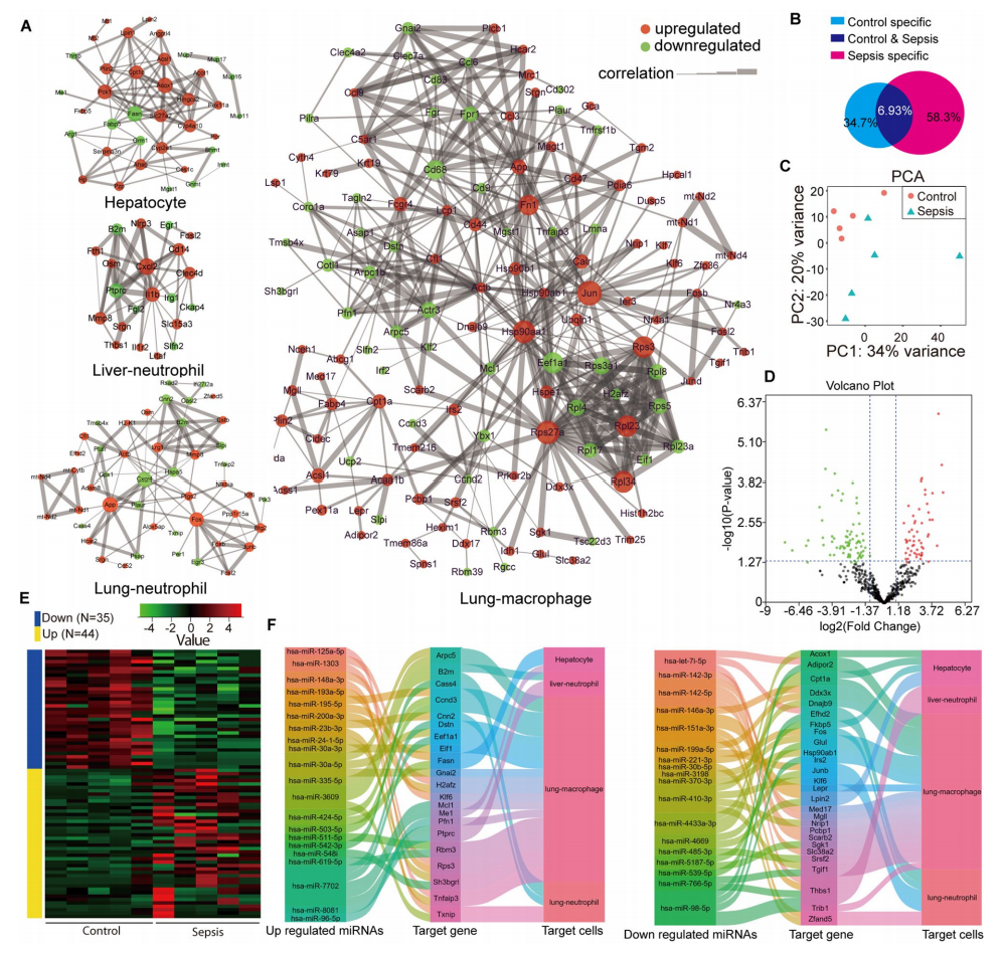
作者提出一种靶点筛选新策略:通过scRNA测序和sEV-miRNA靶基因图谱的相关分析来预测sEV-miRNA向特定细胞的传递。脓毒症患者sEVs 将miR-125a-5p传递给肺巨噬细胞以抑制 Tnfaip3,并将miR-221-3p传递给中性粒细胞以抑制Fos。含有 miR-125a-5p 抑制剂或 miR-221-3p 模拟物的巨噬细胞膜纳米囊泡可减轻LPS诱导的小鼠急性肺损伤。我们的研究结果为干预和减少脓毒症期间由EV诱发的器官损伤(尤其是肺损伤)提出了新的治疗策略和靶点。
参考文献:
Macrophage biomimetic nanoparticle-targeted functional extracellular vesicle micro-RNAs revealed via multiomics analysis alleviate sepsis-induced acute lung injury. J Nanobiotechnology, 2024. 22(1): p. 362.
外泌体资讯网 J Nanobiotechnology南方医科大学李旭/孟莹:巨噬细胞仿生纳米囊泡靶向MicroRNA缓解脓毒症诱发的急性肺损伤





