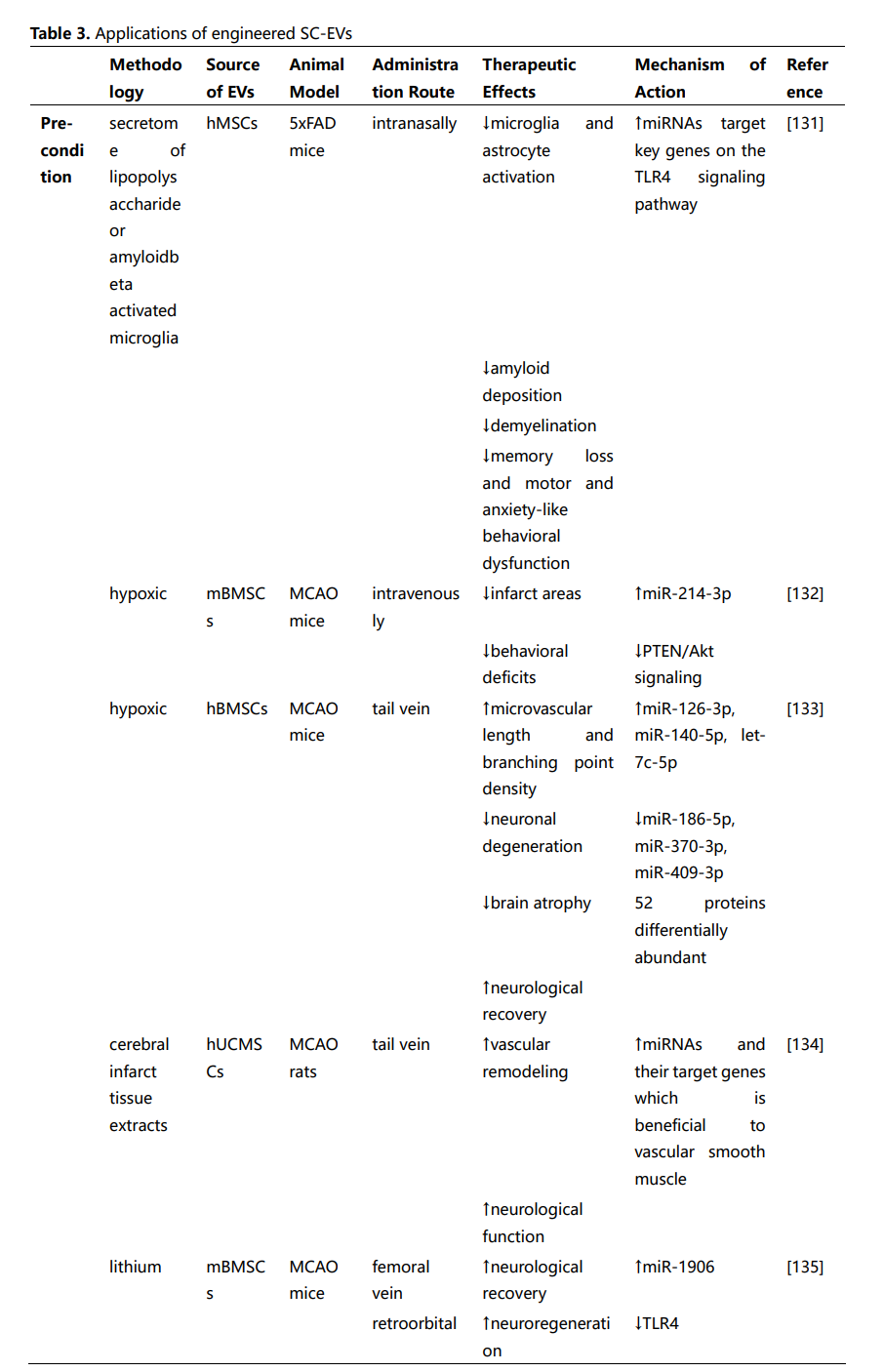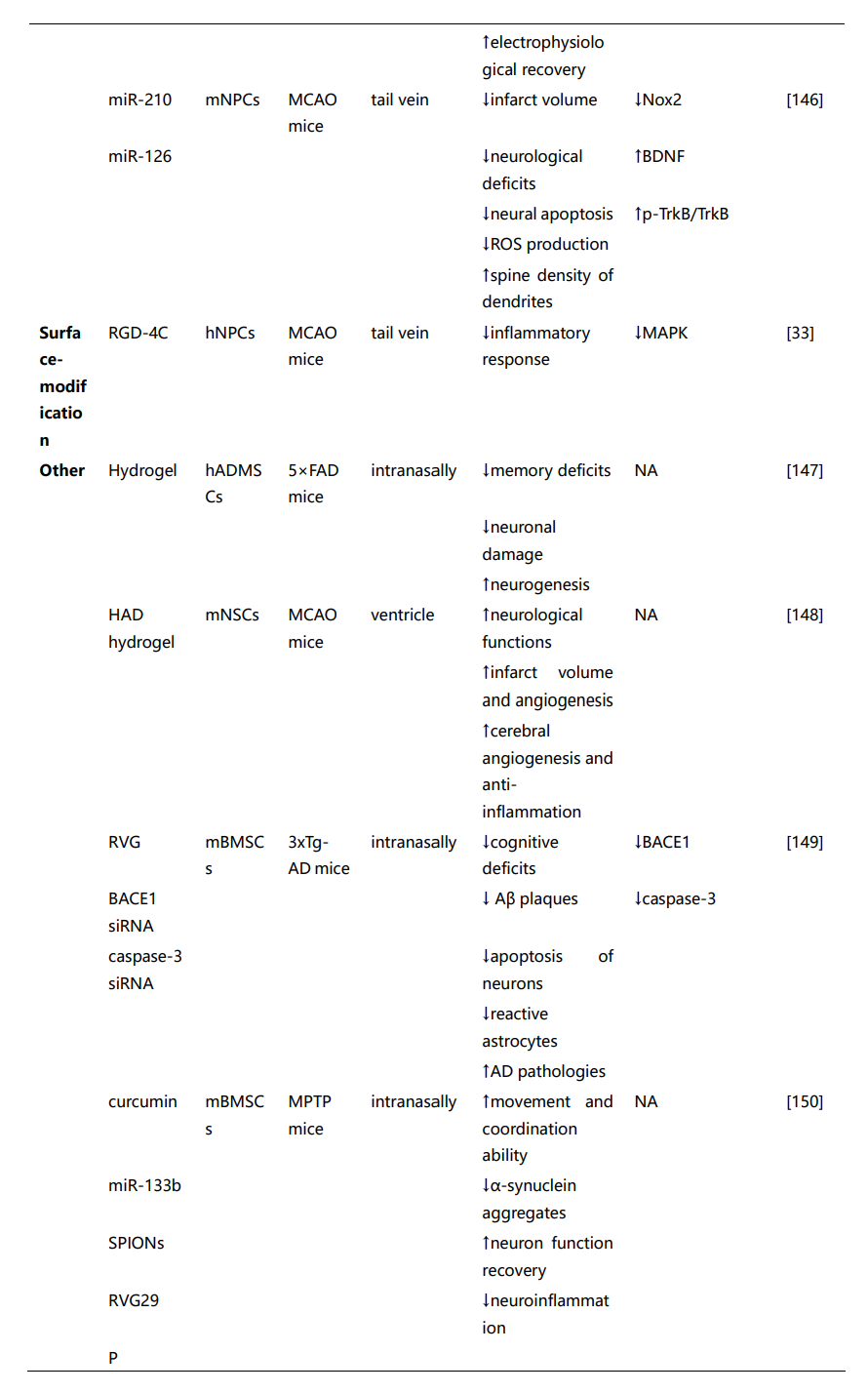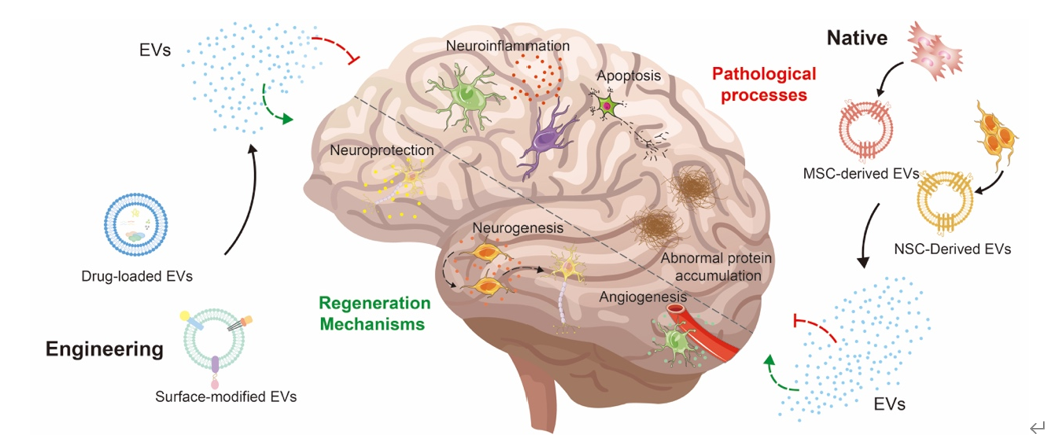
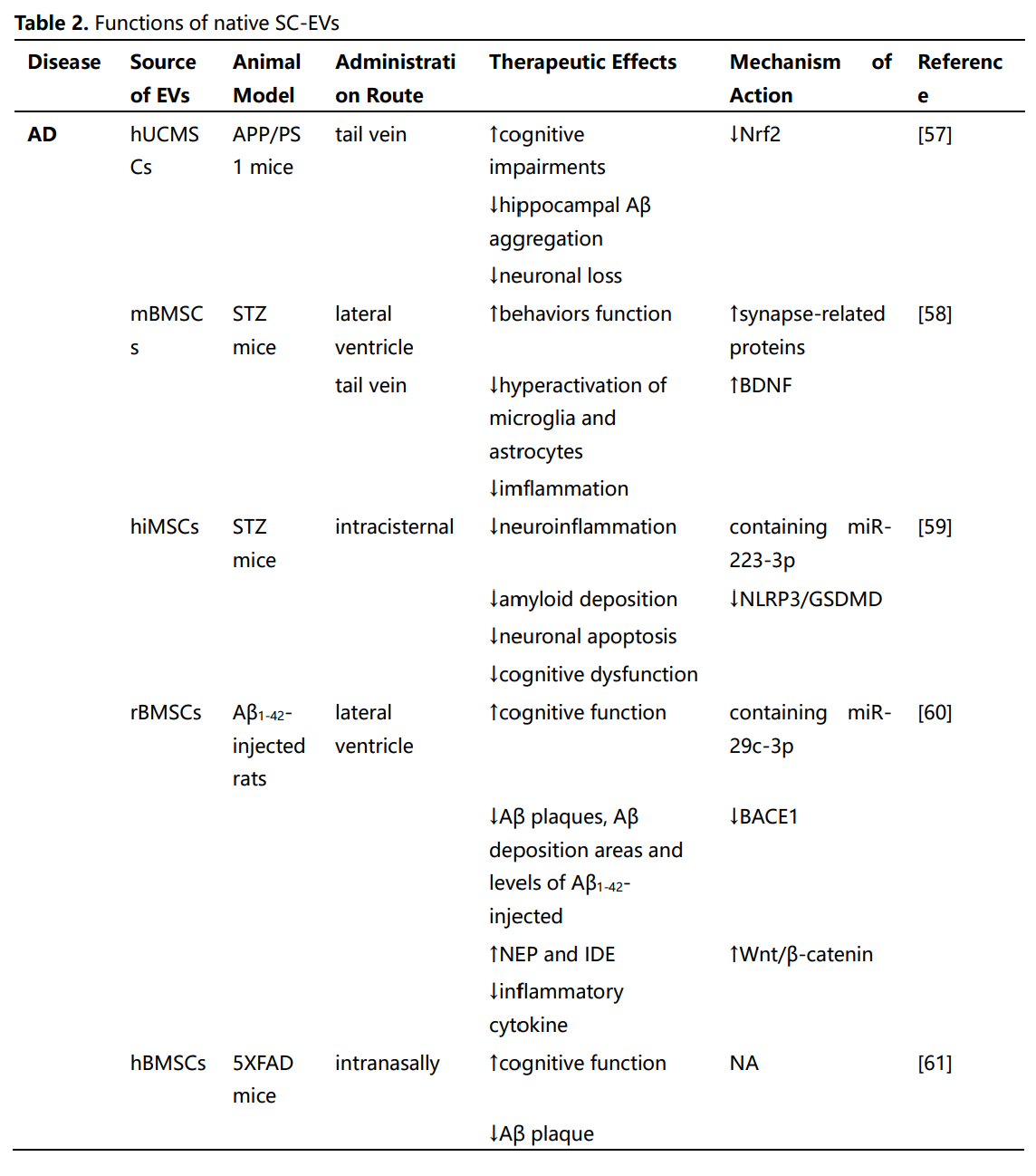
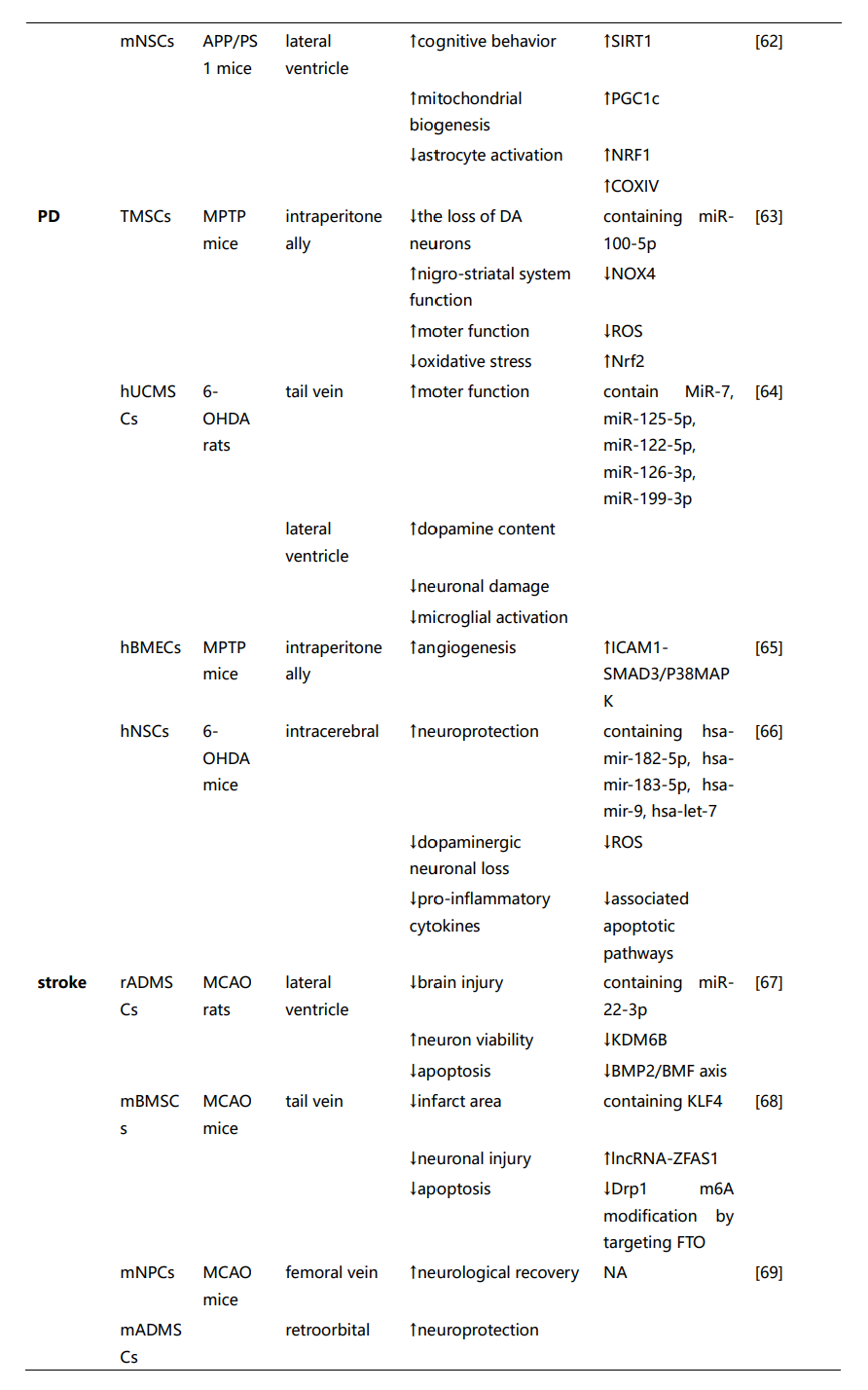

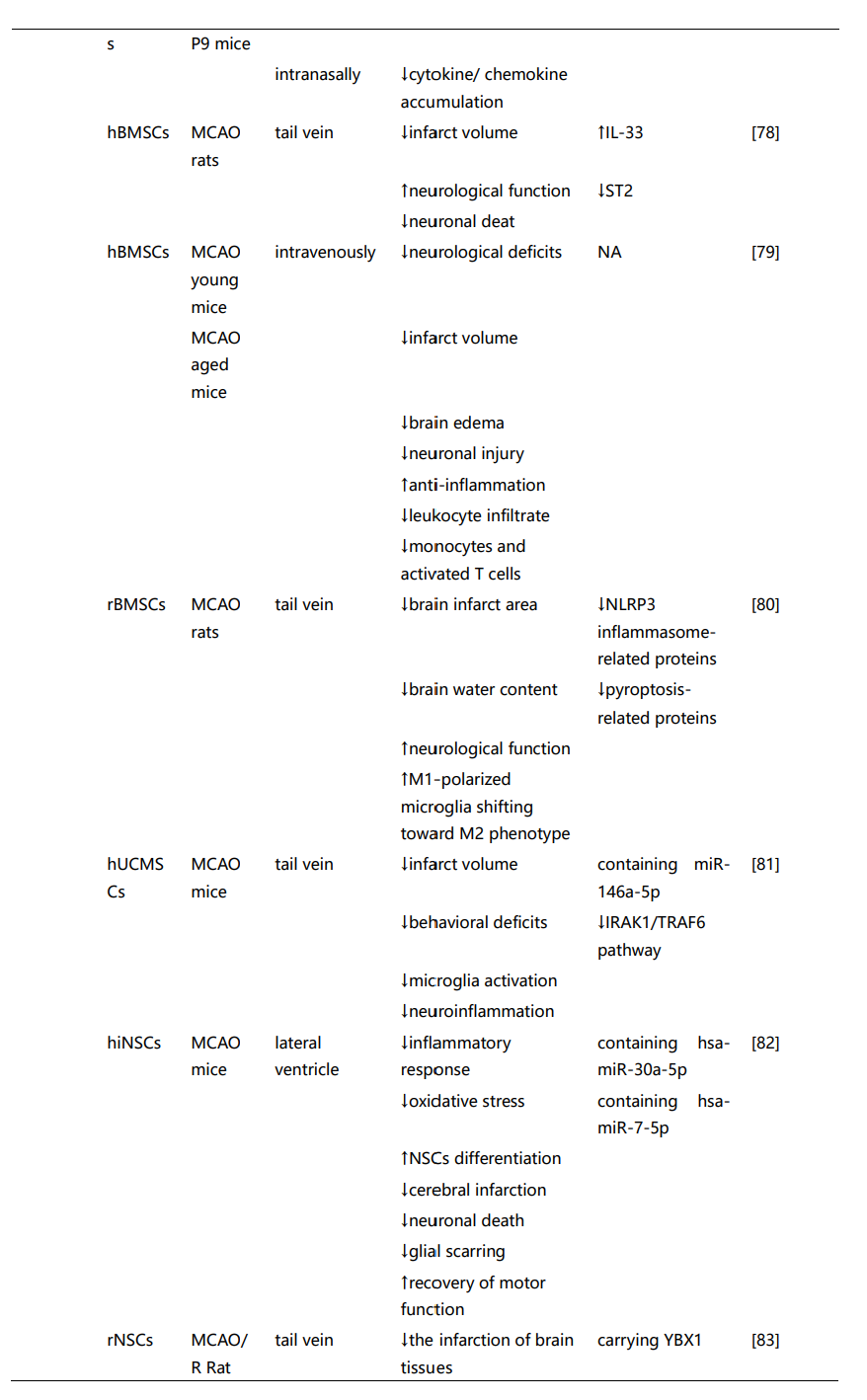
 这些研究强调了间充质干细胞来源的EVs(MSC-EVs)和神经干细胞来源的EVs(NSC-EVs)在治疗神经系统疾病中的潜在治疗应用。尽管通过不同的机制组合促进神经修复,但两种类型的EVs都提供了类似的治疗效果,包括神经保护、血管生成和保持血脑屏障的完整性、缓解神经炎症等功能。然而,选择最适合特定神经疾病的SC-EVs仍然不确定。虽然一些研究表明,在NSC-EVs和MSC-EVs治疗效果的比较分析中,NSC-EVs可能比MSC-EVs更有效。然而,这些发现不应被解读为表明MSC-EVs本质上不如NSC-EVs。因此,需要进一步的证据和对基础机制的更好理解,以促进这些发现向临床应用的转化。
这些研究强调了间充质干细胞来源的EVs(MSC-EVs)和神经干细胞来源的EVs(NSC-EVs)在治疗神经系统疾病中的潜在治疗应用。尽管通过不同的机制组合促进神经修复,但两种类型的EVs都提供了类似的治疗效果,包括神经保护、血管生成和保持血脑屏障的完整性、缓解神经炎症等功能。然而,选择最适合特定神经疾病的SC-EVs仍然不确定。虽然一些研究表明,在NSC-EVs和MSC-EVs治疗效果的比较分析中,NSC-EVs可能比MSC-EVs更有效。然而,这些发现不应被解读为表明MSC-EVs本质上不如NSC-EVs。因此,需要进一步的证据和对基础机制的更好理解,以促进这些发现向临床应用的转化。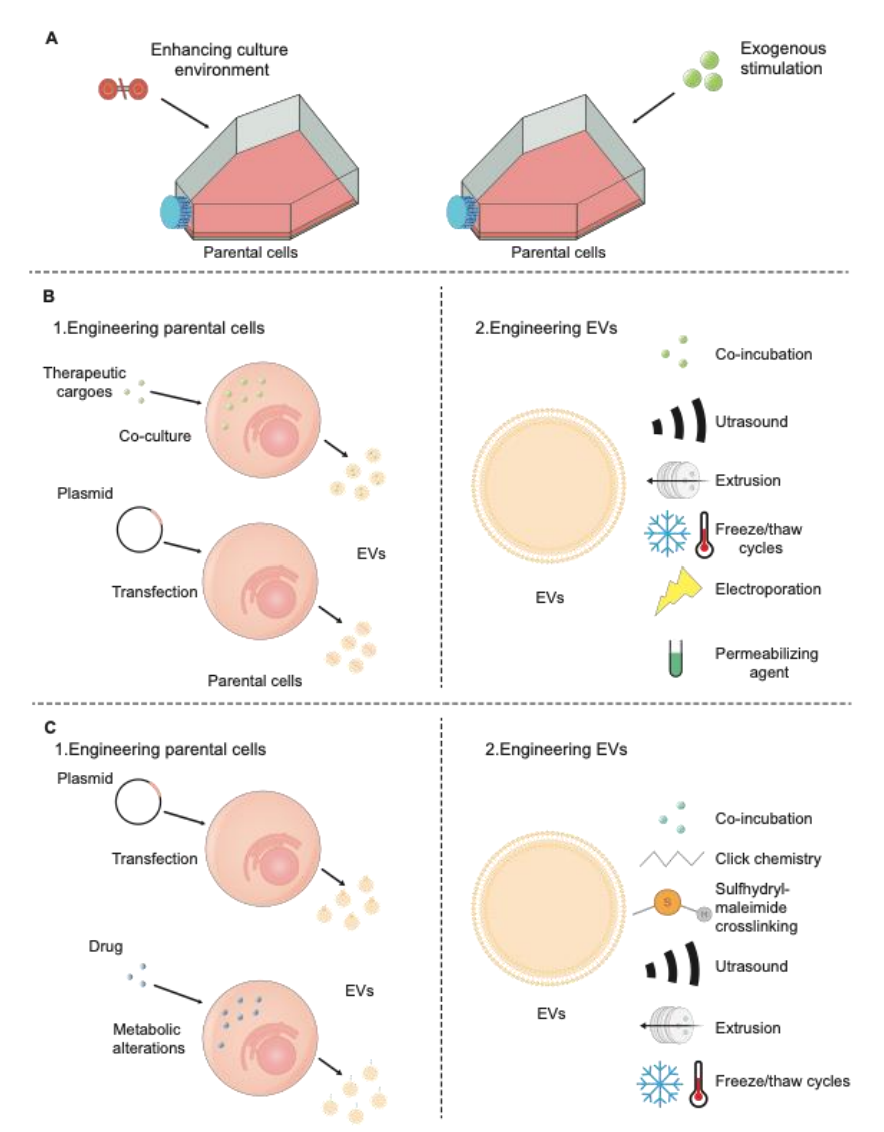
外泌体资讯网 Theranostics|中国生物研究院和中国科学院过程工程研究所:干细胞来源的EVs对阿尔茨海默病、帕金森病和脑卒中的治疗干预