肿瘤分泌的细胞外囊泡(TEV)携带大量癌症相关蛋白,对肿瘤发生、发展和免疫反应调节至关重要。然而,TEV上存在的蛋白并不完全是肿瘤细胞特有的,正常和肿瘤细胞分泌的EV在大小和蛋白质表达上具有相似性。当前的EV检测和定量方法主要集中在单一生物标志物检测上,难以确认信号是源自肿瘤还是非肿瘤EV。此外,EV体积小且蛋白质生物标志物的低丰度也阻碍了TEV在疾病诊断中的应用。为此,东北大学于永亮教授团队在Analytical Chemistry杂志上发表了题为“Ultrasensitive and Wash-Free Detection of Tumor Extracellular Vesicles by Aptamer-Proximity-Ligation-Activated Rolling Circle Amplification Coupled to Single Particle ICP-MS”的论文,该论文利用双适配体同时识别EV膜上癌蛋白,结合滚环扩增和单颗粒ICP-MS,实现了TEV的灵敏检测及癌症诊断。论文第一作者为博士研究生张学伟,通讯作者为于永亮教授。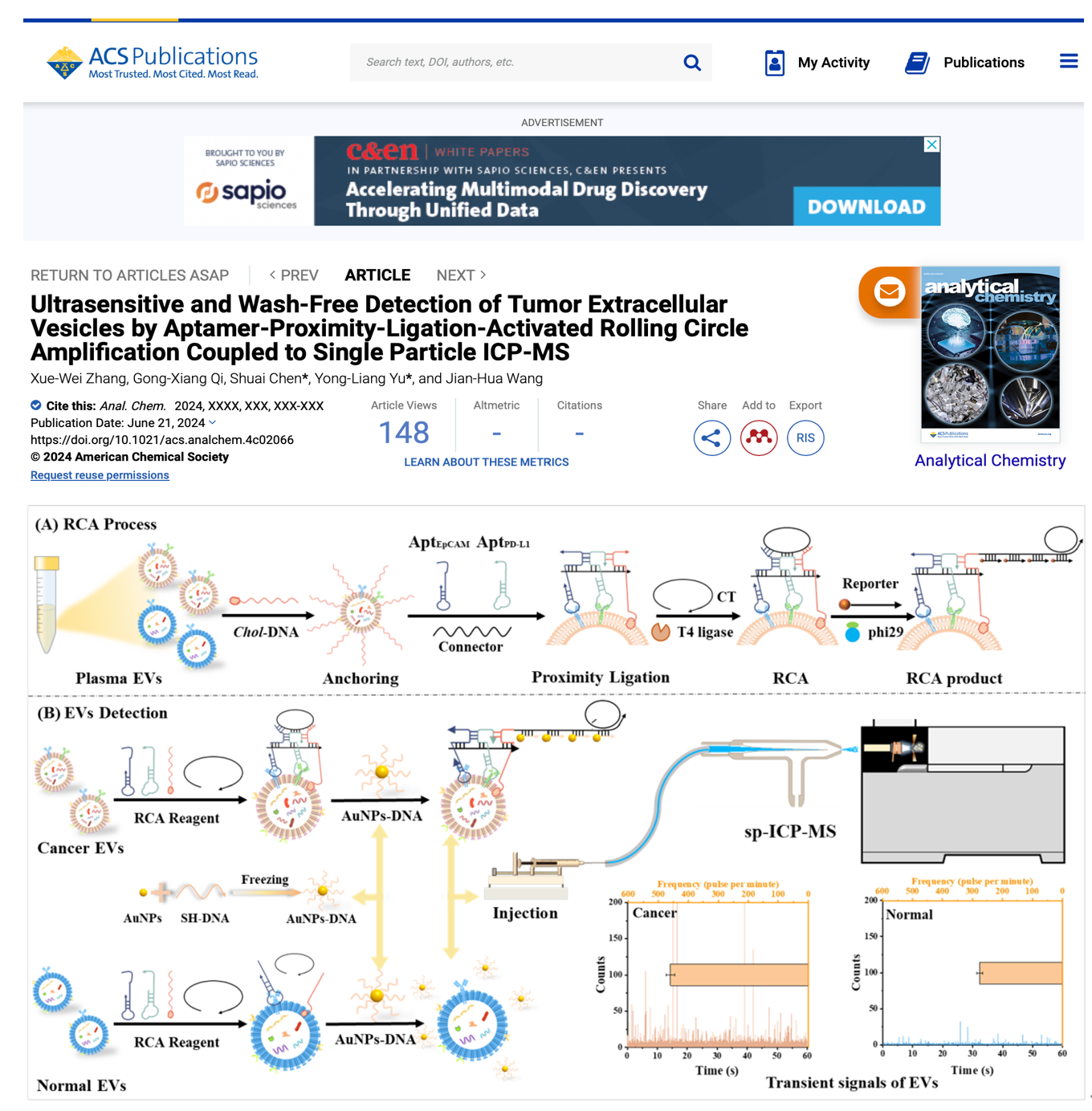
在作者的整体设计中,(胆固醇)chol-T2探针首先与EV膜结合,当两种蛋白质在EV膜上同时表达时,AptEPCAM和AptPD-L1识别相应的蛋白质,借助连接器探针在膜上形成稳定的结构。接下来,添加CT链和T4连接酶以形成环状DNA。随后,加入phi29酶和dNTP启动RCA扩增。最后,AuNP标记的探针与RCA扩增产物结合以进行单颗粒检测。相反,不表达或仅表达一种靶蛋白的EV无法触发RCA扩增,因此,不能在sp-ICP-MS上产生信号。由此实现了TEV的高灵敏度、低背景、免清洗检测。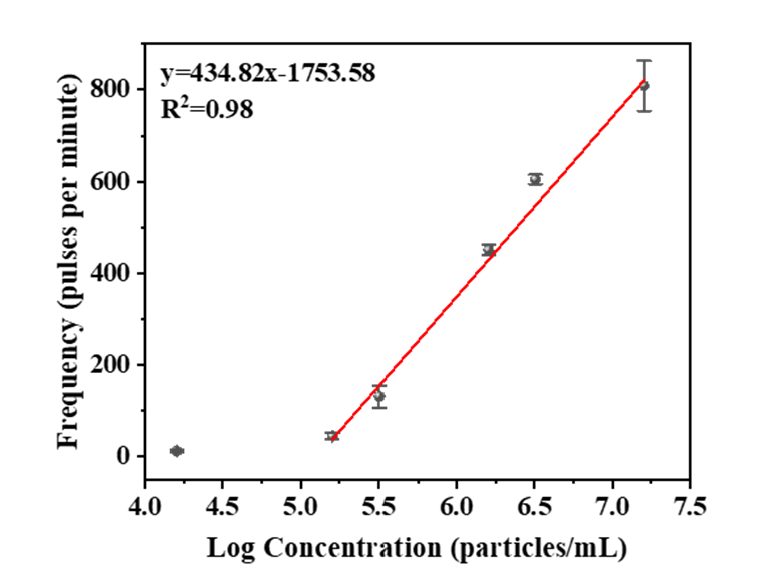
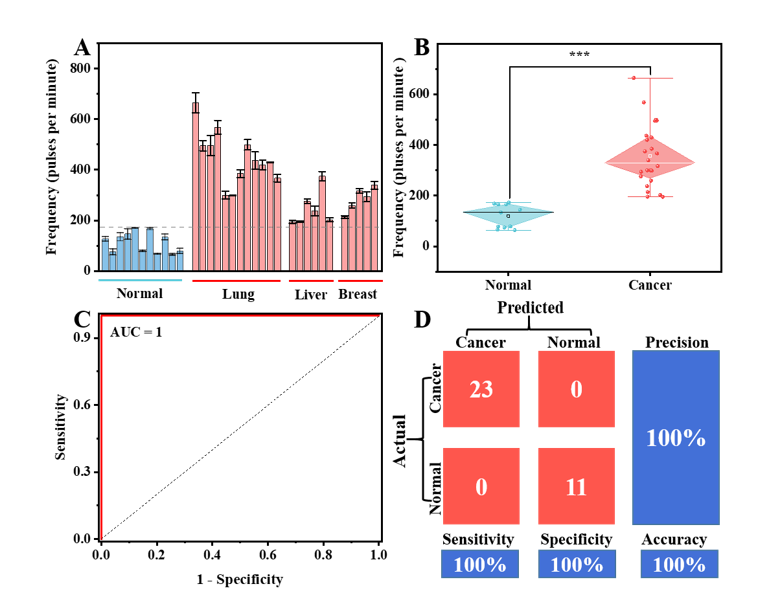
利用这种方法,作者在105–107 particles/mL范围内构建了良好的线性关系,检测限为1.1 × 104 particles/mL。对34个临床样本中TEV的表达水平分析显示,癌症患者血浆样本中TEV的峰信号明显更多。此外,ROC曲线显示利用TEV能实现准确的癌症诊断(AUC = 1)。混淆矩阵表明TEV对癌症诊断显示出100%的灵敏度和100%的特异性。结果表明了TEV在临床癌症诊断中的潜在价值。总体结果表明,由于简单的操作以及出色的灵敏度和准确性,该方法在生命科学和精准医疗等领域中具有一定的应用潜力。Ultrasensitive and Wash-Free Detection of Tumor Extracellular Vesicles by Aptamer-Proximity-Ligation-Activated Rolling Circle Amplification Coupled to Single Particle ICP-MS. Anal Chem. 2024 Jun 21. DOI: 10.1021/acs.analchem.4c02066.外泌体资讯网 Anal Chem|东北大学于永亮教授团队:适配体邻近连接激活滚环扩增结合单颗粒ICP-MS对肿瘤源细胞外囊泡超灵敏免洗检测