细胞外囊泡(extracellular vesicles,EVs)是由细胞释放、包裹脂质双分子层的纳米级颗粒,内含多种生物活性物质,参与细胞间通讯,在生物医学中的重要作用日益凸显。根据国际指南MISEV2023,基于差速离心法可分离得到大EVs和小EVs两个亚群体,尽管小EVs目前研究最为成熟和深入,具有较好的安全性,是基础和临床转化研究的热点,但大EVs也具有独特的生物标志物、内含物和临床应用前景,而对于大EVs的安全性研究鲜见报道。间充质干细胞来源EVs(MSC-EVs)因其低免疫原性和母细胞相似的再生能力,被视为极可能替代MSC的“无细胞”治疗方案。目前缺乏针对大MSC-EVs在促凝风险程度、机制和防治策略方面的报道,亟需对其展开深入研究以解决这一临床转化应用必须面对的重大安全性问题。
华中科技大学同济医学院附属协和医院李秋柏教授和陈智超教授课题组多年来持续关注和从事肿瘤细胞、MSC等来源的大EVs功能和安全性研究,取得了系列成果。课题组前期研究表明,脐带间充质干细胞来源大囊泡(UC-EVs)可明显延缓自然衰老小鼠的衰老和骨骼、肾脏、血管平滑肌等多种组织器官的退行性变,工程化改造的UC-EVs可以特异性靶向衰老肺泡上皮,高效治疗肺纤维化。近期在Acta Pharmacologica Sinica杂志上发表题为“Lethal pulmonary thromboembolism in mice induced by intravenous human umbilical cord mesenchymal stem cell-derived large extracellular vesicles in a dose- and tissue factor-dependent manner”的研究成果。
在这项研究中,课题组进一步系统探讨了UC-EVs的体内外促凝血活性及机制。研究结果显示,在体外,UC-EVs能够通过剂量和组织因子依赖性方式激活凝血;而在体内,高剂量UC-EVs(大于1 μg/g 体重)的静脉注射可能导致小鼠出现血小板和纤维蛋白原耗竭、凝血时间延长以及肺血栓形成,进而引发肺血栓栓塞和急性死亡。为了应对这一风险,课题组提出并证实了两种有效的预防策略:降低输注速率或预先注射肝素抗凝,这两种方法能够显著降低高剂量UC-EVs应用时的风险,为未来临床追求剂量依赖性疗效时提供了化解高凝风险的有效手段。
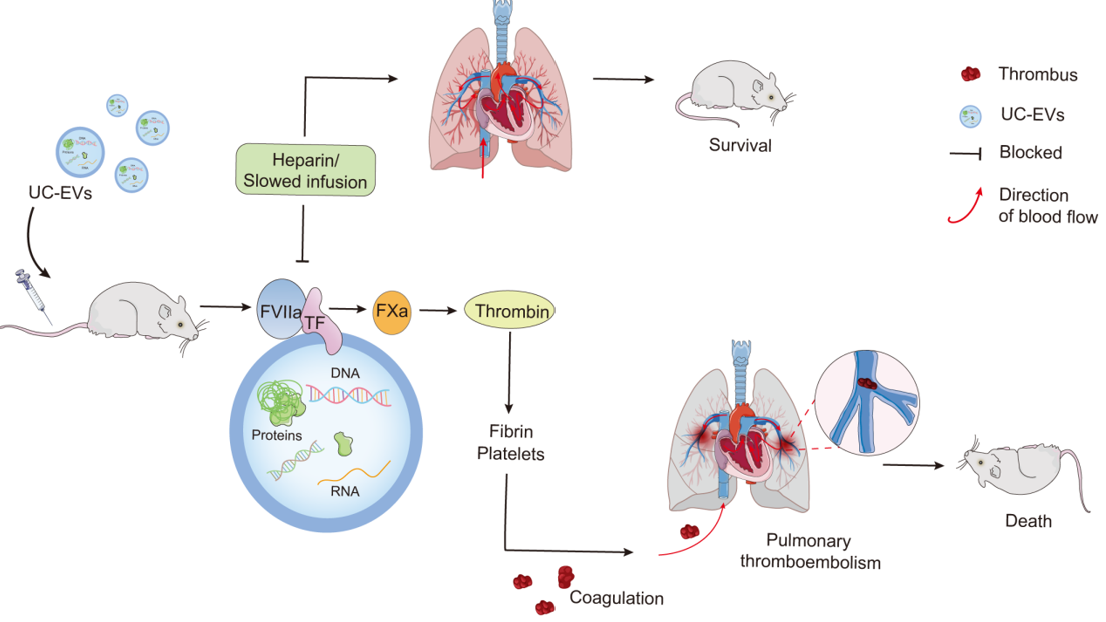
图注:UC-EVs通过TF/FVIIa通路激活凝血级联反应引发小鼠致死性肺栓塞和预防策略
这项研究首次详细阐述了大UC-EVs静脉给药过程中的凝血风险,确定了静脉注射剂量的安全上限,并提供了有效的预防策略。这些成果不仅为大UC-EVs的临床应用提供了重要的安全指导,也为基于其它来源的大EVs功能开发和临床转化应用奠定了坚实的基础。团队博士研究生杨汴蕾和隆耀莹为论文的共同第一作者,李秋柏教授为通讯作者,该项工作受到十四五国家重点研发计划干细胞重点专项项目、国家自然科学基金面上项目以及湖北省创新群体项目等多个项目的资助。
参考文献:Lethal pulmonary thromboembolism in mice induced by intravenous human umbilical cord mesenchymal stem cell-derived large extracellular vesicles in a dose- and tissue factor-dependent manner. Acta Pharmacol Sin. 2024 Jun 24. doi: 10.1038/s41401-024-01327-3.
外泌体资讯网 Acta Pharmacol Sin|武汉协和医院李秋柏/陈智超:静脉注射人间充质干细胞大囊泡诱发小鼠发生致死性肺血栓栓塞





