近年来,随着我国人口的老龄化,骨质疏松的发病率不断增高,严重影响老年人群的身体健康。目前,大多数一线抗骨质疏松药物都是抑制骨吸收的抗分解代谢药物,但是单纯抑制骨吸收无法有效恢复生理性的骨改建平衡,急需研发新型的促骨形成药物。间充质干细胞(mesenchymal stem cells, MSCs)因其自我更新、多谱系分化和免疫调节等特性,已作为细胞治疗策略广泛应用于骨组织再生和退行性骨疾病治疗。但是研究发现,大部分干细胞系统注射后仅能在体内维持短时期的存活,探索移植后发生凋亡的MSCs如何发挥骨质疏松治疗作用已成为重要的科学问题。
近日,四川大学华西口腔医院廖立研究员/田卫东教授团队在生物医学1区杂志Theranostics (最新 IF: 12.4)上发表论文,报道了干细胞来源的凋亡囊泡是治疗骨质疏松的关键介质并研究了其分子机制,发现干细胞在治疗骨质疏松中的作用机制,推动了基于凋亡囊泡的新型无细胞治疗策略的研发。
凋亡囊泡 (apoptotic cells derived extracellular vesicles, ApoEVs),是细胞在凋亡过程中产生的细胞外囊泡。ApoEVs可以运输多种生物活性成分,如蛋白质、脂质、核酸等,发挥细胞间信息交流的重要作用。此项研究中,该团队通过活体示踪发现骨髓间充质干细胞(BMSCs)在静脉输注后出现凋亡,产生大量的ApoEVs。随后,通过梯度密度离心的方式分离纯化ApoEVs,对ApoEVs进行了蛋白组学分析发现,ApoEVs内携带了与细胞吞噬、增殖、迁移及分化相关的功能蛋白。体内外实验与蛋白组学结果一致,ApoEVs能够通过血液循环到达骨组织并被BMSCs吞噬,从而促进BMSCs增殖、迁移及成骨分化。
此外,该团队发现,注射ApoEVs能明显改善小鼠的骨质疏松,且与注射BMSCs具有相似的治疗效果。更进一步,该团队采用蛋白组学技术,分析比较了ApoEVs与BMSCs关键蛋白。发现的ApoEVs通过转运Ras蛋白,激活Ras/Raf1/Mek/Erk分子途径改善BMSCs的功能,从而促进骨质疏松小鼠的骨形成。
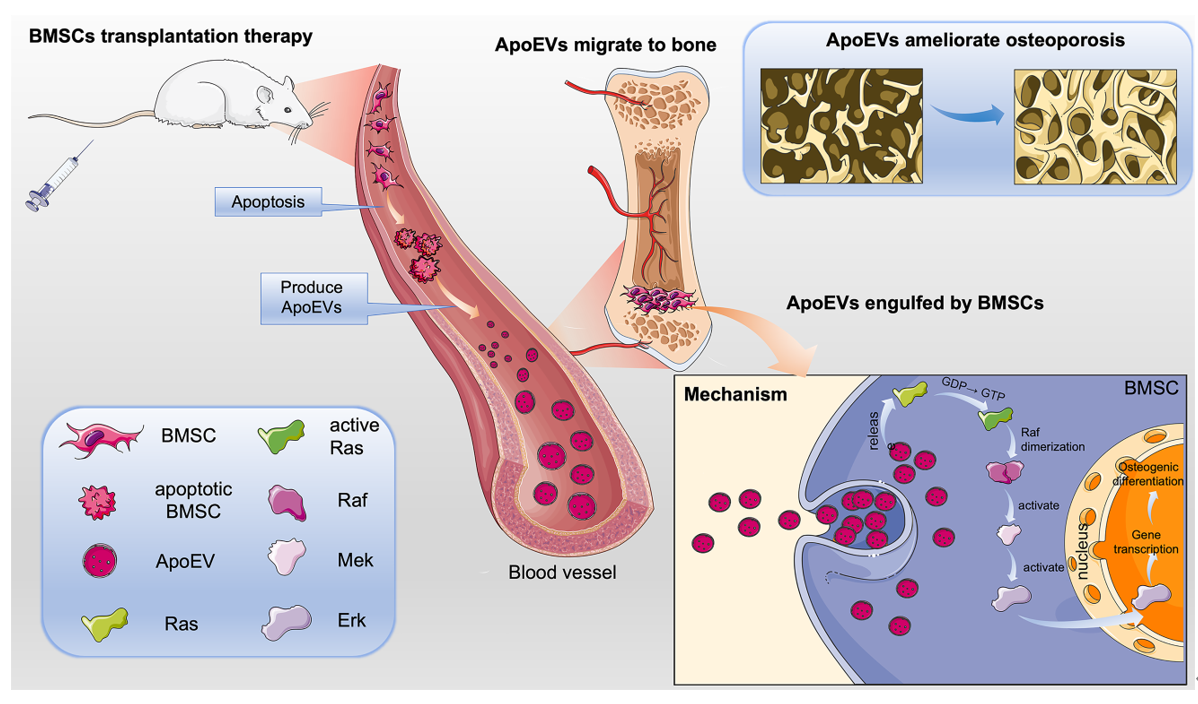
该研究深入解析了MSC细胞治疗的机制,证明凋亡BMSCs产生的ApoEVs是干细胞输注治疗骨质疏松的关键途径。ApoEVs可以携带趋化相关蛋白、吞噬相关蛋白和以及参与细胞增殖和分化的生物活性蛋白,在循环系统中靶向到骨组织,被内源性BMSCs吞噬后,通过转运Ras蛋白等活性成分发挥功能。这一结论增强了对干细胞治疗机制的理解,并为研发基于ApoEVs的无细胞治疗的策略奠定基础。
四川大学华西口腔医院的廖立研究员和田卫东教授为文章的共同通讯作者,课题组成员李茂娇博士研究生为文章的第一作者。
参考文献:
Extracellular vesicles from apoptotic BMSCs ameliorate osteoporosis via transporting regenerative signals. Theranostics. 2024. 14(9): 3583-3602.
原文链接:https://www.thno.org/v14p3583.htm
外泌体资讯网 Theranostics | 四川大学华西口腔医院廖立/田卫东教授团队: 发现干细胞源性凋亡囊泡治疗骨质疏松的分子机制





