细胞外囊泡(Extracellular Vesicles, EVs)是细胞分泌的纳米级膜包裹颗粒。近年来越来越多的证据表明,EVs是肿瘤微环境的关键组成部分。肿瘤微环境中的多种细胞类型产生EVs,作为自分泌或旁分泌信号,促进肿瘤迁移和侵袭、介导免疫抑制、增强血管生成,并促进转移前微环境的形成。多项研究表明,肿瘤来源的EVs在肿瘤进展过程中会发生一系列货物组装和生物活性的改变。然而,肿瘤细胞如何调节自身EVs的生物发生和分泌通路从而促进肿瘤发展,具体机制尚不清楚。近日,苏州大学苏州医学院生命科学学院张艳岭副教授、苏雄教授和西交利物浦大学的宋建瑞副教授领衔的研究团队在国际知名生物学期刊BMC Biology上发表了题为“Endosomal protein DENND10/FAM45A integrates extracellular vesicle release with cancer cell migration”的论文(2024 Jul 10;22(1):154),证明:胞内体蛋白DENND10通过调控EVs释放来重塑肿瘤微环境,从而促进肿瘤细胞的运动能力和侵袭性。
EV释放与细胞内的胞内体-溶酶体系统的稳态密切相关。DENND10主要定位于晚胞内体和溶酶体,这些是EVs的主要来源之一。该研究团队通过生物信息学数据挖掘发现,DENND10表达与多种癌症类型的不良预后显著相关,且在转移性乳腺癌细胞系中上调。DENND10基因敲除乳腺癌细胞分泌的EVs数量下降,这是由于胞内体-溶酶体系统的运输稳态被干扰所致。同时,DENND10缺失导致细胞延展、迁移、侵袭和体内转移的能力降低,骨架蛋白在细胞内的组装发生紊乱,尤其是stress fiber和focal adhesion等重要运动结构的形成受损。更重要的是,这些细胞运动表型的改变可归因至细胞EVs释放能力的改变。来自野生型细胞的条件培养基或EVs能够挽救DENND10缺失细胞的迁移能力和细胞骨架蛋白组装。在等质量对比条件下,DENND10缺失细胞本身释放的EVs明显出现活性下降。蛋白质组学分析显示,DENND10缺失导致EVs组成发生显著变化,尤其是EVs中的细胞外基质(ECM)和细胞黏附分子亚型发生重塑。多项研究表明,EVs可以作为黏附热点,并通过其表面的ECM和黏附蛋白提供空间定位信号促进细胞迁移。由于DENND10缺失导致了EV数量减少和组成改变,因此stress fiber和focal adhesion等关键运动结构的形成也相应受阻。这项研究还发现,外源性ECM可挽救DENND10缺失细胞的迁移表型,进一步表明了DENND10通路在肿瘤微环境中的重要作用。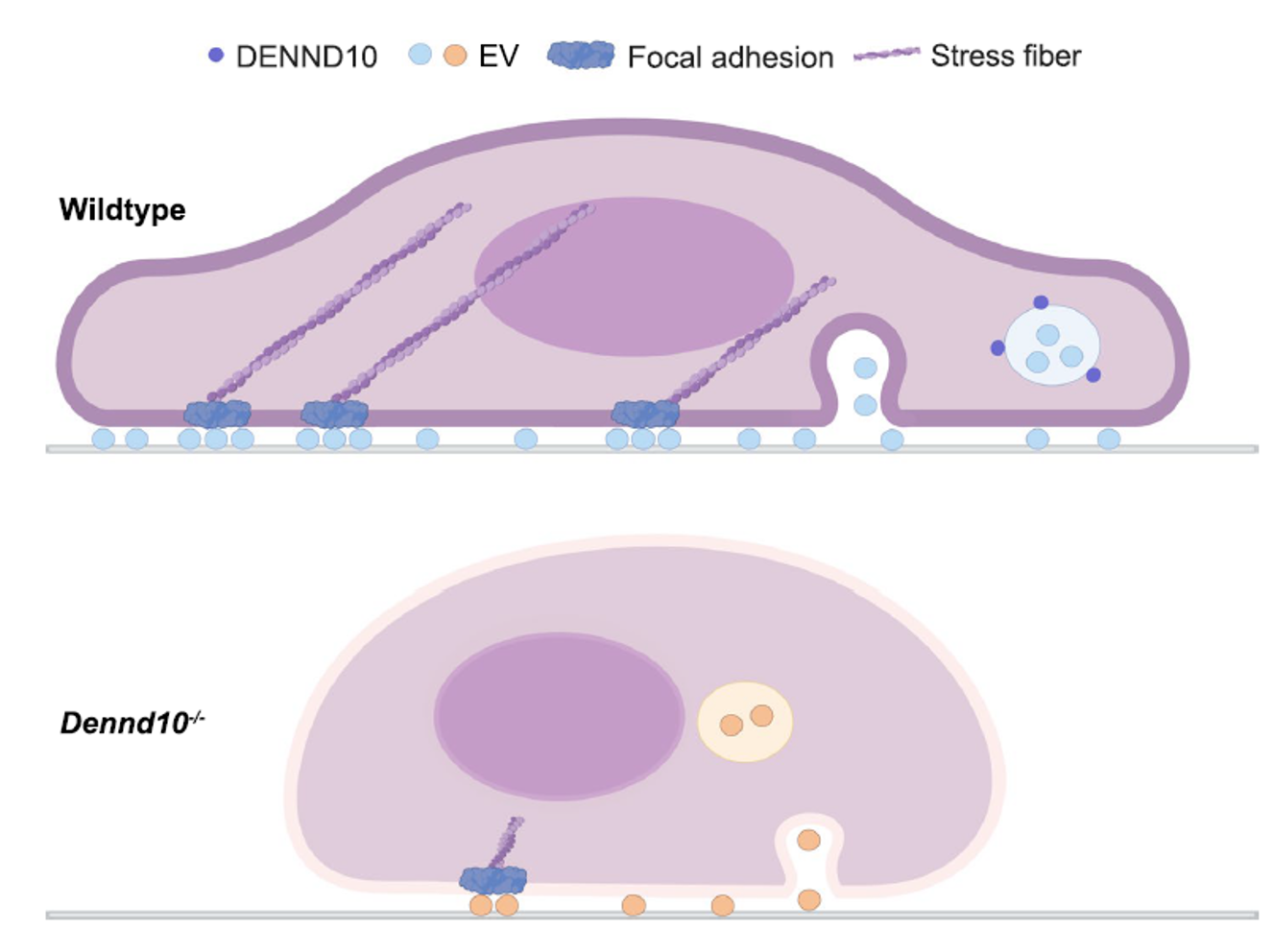 图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。作为一种EVs释放调节通路,DENND10通过调节肿瘤细胞自分泌EVs的数量和组成,改变和重塑肿瘤微环境,从而调控肿瘤细胞的迁移潜能。这一发现为侵袭性肿瘤的靶向治疗提供了新思路。团队研究生孙慎青、李倩和刘刚刚为论文的共同第一作者。该项工作受到国家自然科学基金面上项目、科技部重点研发项目和教育部重点实验室等多个项目的资助。Endosomal protein DENND10/FAM45A integrates extracellular vesicle release with cancer cell migration. BMC Biology. 2024 July 10. DOI: https://doi.org/10.1186/s12915-024-01948-4
图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。作为一种EVs释放调节通路,DENND10通过调节肿瘤细胞自分泌EVs的数量和组成,改变和重塑肿瘤微环境,从而调控肿瘤细胞的迁移潜能。这一发现为侵袭性肿瘤的靶向治疗提供了新思路。团队研究生孙慎青、李倩和刘刚刚为论文的共同第一作者。该项工作受到国家自然科学基金面上项目、科技部重点研发项目和教育部重点实验室等多个项目的资助。Endosomal protein DENND10/FAM45A integrates extracellular vesicle release with cancer cell migration. BMC Biology. 2024 July 10. DOI: https://doi.org/10.1186/s12915-024-01948-4外泌体资讯网 BMC Biology|苏州大学张艳岭/苏雄和西交利物浦大学宋建瑞团队:细胞外囊泡释放通路促进肿瘤细胞迁移
 图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。
图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。 图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。
图注. DENND10通过调节EVs释放介导肿瘤细胞迁移。