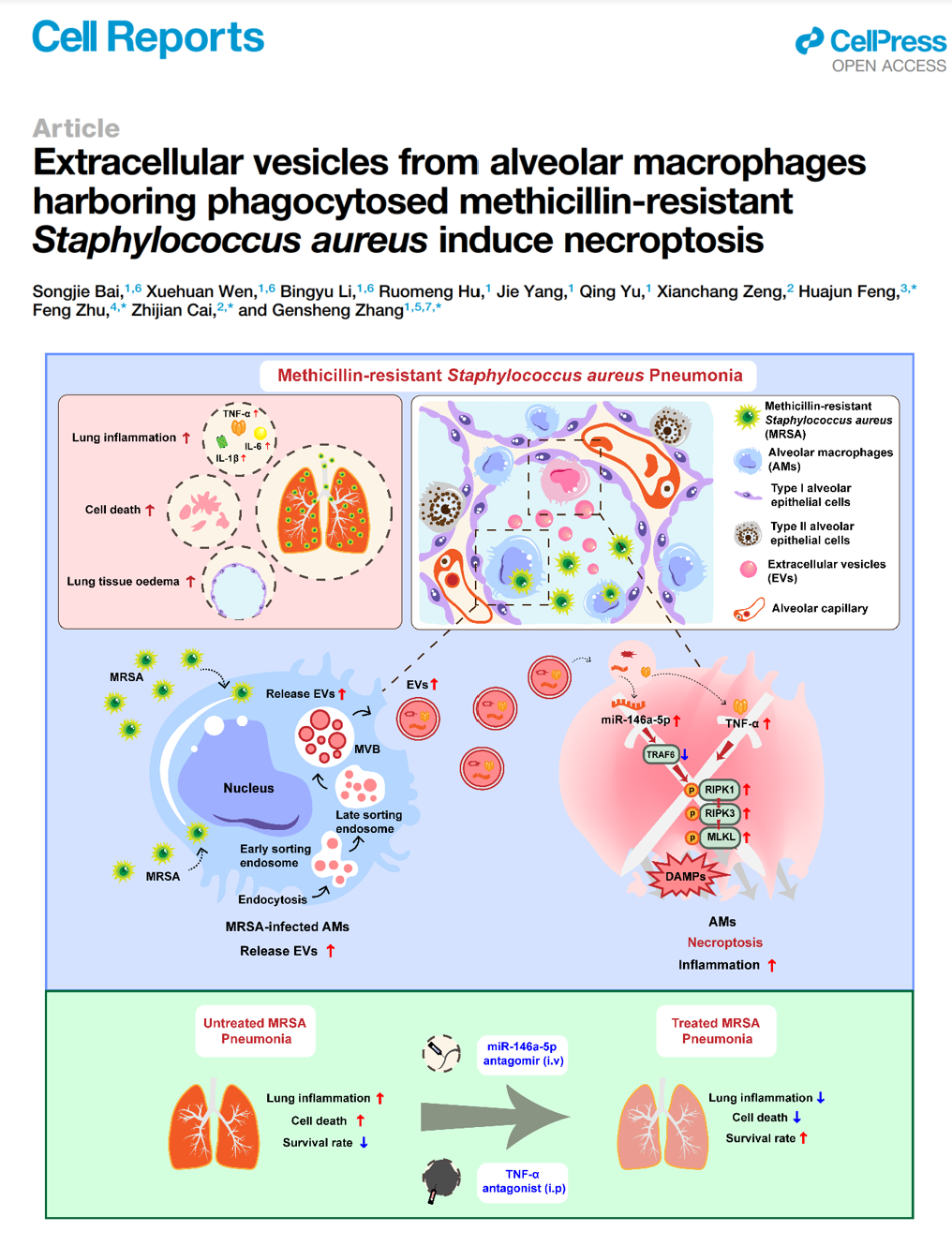
耐甲氧西林金黄色葡萄球菌(MRSA)是一种医院获得性和社区相关性肺炎的主要病原体,目前MRSA肺炎仍具有较高的发生率和死亡率,是全球公共卫生的重大威胁之一。探究MRSA肺炎的内在机制是开发有效防治其发生发展策略的关键所在。胞外囊泡(EVs)是一类原核生物和真核生物皆可向外分泌的纳米级别颗粒,是细胞间通讯的重要载体,其不仅可由正常细胞所分泌,病原微生物及病理状态的细胞同样会向外分泌EVs。在MRSA肺炎中,MRSA感染对肺泡巨噬细胞(AMs)分泌EVs的影响,以及吞噬MRSA后AMs分泌的EVs是否参与了MRSA肺炎的发生发展仍不清楚。
2024年7月9日,浙江大学医学院附属第二医院张根生主任医师、浙江大学基础医学院/医学院附属第二医院蔡志坚教授、同济大学附属东方医院朱峰教授和浙江农林大学冯华军教授课题组联合在Cell子刊Cell Reports杂志上发表题为“Extracellular vesicles from alveolar macrophages harboring phagocytosed methicillin-resistant Staphylococcus aureus induce necroptosis”的研究论文(2024 Jul 9; 43(7):114453)。该研究取得以下主要新发现:① MRSA肺部感染会促进AMs向外分泌更多的EVs;② 吞噬MRSA后AMs分泌的EVs,携带TNF-α及多种坏死性凋亡相关蛋白,在体内外均有明显的促炎、促细胞死亡作用,并且会导致AMs发生坏死性凋亡;③ 机制上,AMs分泌的EVs其上调的miR-146a-5p通过靶向TRAF6,促进RIPK1、RIPK3及MLKL磷酸化,从而加重TNF-α介导的坏死性凋亡;④ 在应用和未应用万古霉素的前提下,联用TNF-α拮抗剂和miR-146a-5p拮抗剂均可以有效治疗小鼠MRSA肺炎(示意图如下)。该研究提示:吞噬MRSA后AMs分泌的EVs通过其携带的TNF-α和miR-146a-5p等效应成分促进AMs坏死性凋亡和MRSA肺炎的发生发展,而靶向抑制TNF-α和miR-146a-5p可以有效减轻MRSA肺炎的发展。为此,该研究为重症感染的发生发展提供一种新机制,为其抗生素外辅助治疗策略提供一种新思路。该研究受国家自然科学基金项目(No. 82270086, No. 81971871和No. 82200087)的资助。
示意图:吞噬MRSA后的肺泡巨噬细胞分泌的胞外囊泡对MRSA肺炎的作用浙江大学医学院附属第二医院张根生主任医师、浙江大学基础医学院/医学院附属第二医院蔡志坚教授、同济大学附属东方医院朱峰教授和浙江农林大学冯华军教授是论文的共同通讯作者。浙江大学医学院附属第二医院白松杰博士、温学欢硕士和李冰玉博士是论文的共同第一作者。参考文献:Extracellular vesicles from alveolar macrophages harboring phagocytosed methicillin-resistant Staphylococcus aureus induce necroptosis. Cell Rep. 2024 Jul 9; 43(7): 114453. doi: 10.1016/j.celrep.2024.114453.
外泌体资讯网 Cell Rep|浙江大学医学院附属第二医院张根生/浙江大学蔡志坚/同济大学朱峰/浙江农林大学冯华军:吞噬MRSA后肺泡巨噬细胞分泌的EVs促进MRSA肺炎发生发展新机制