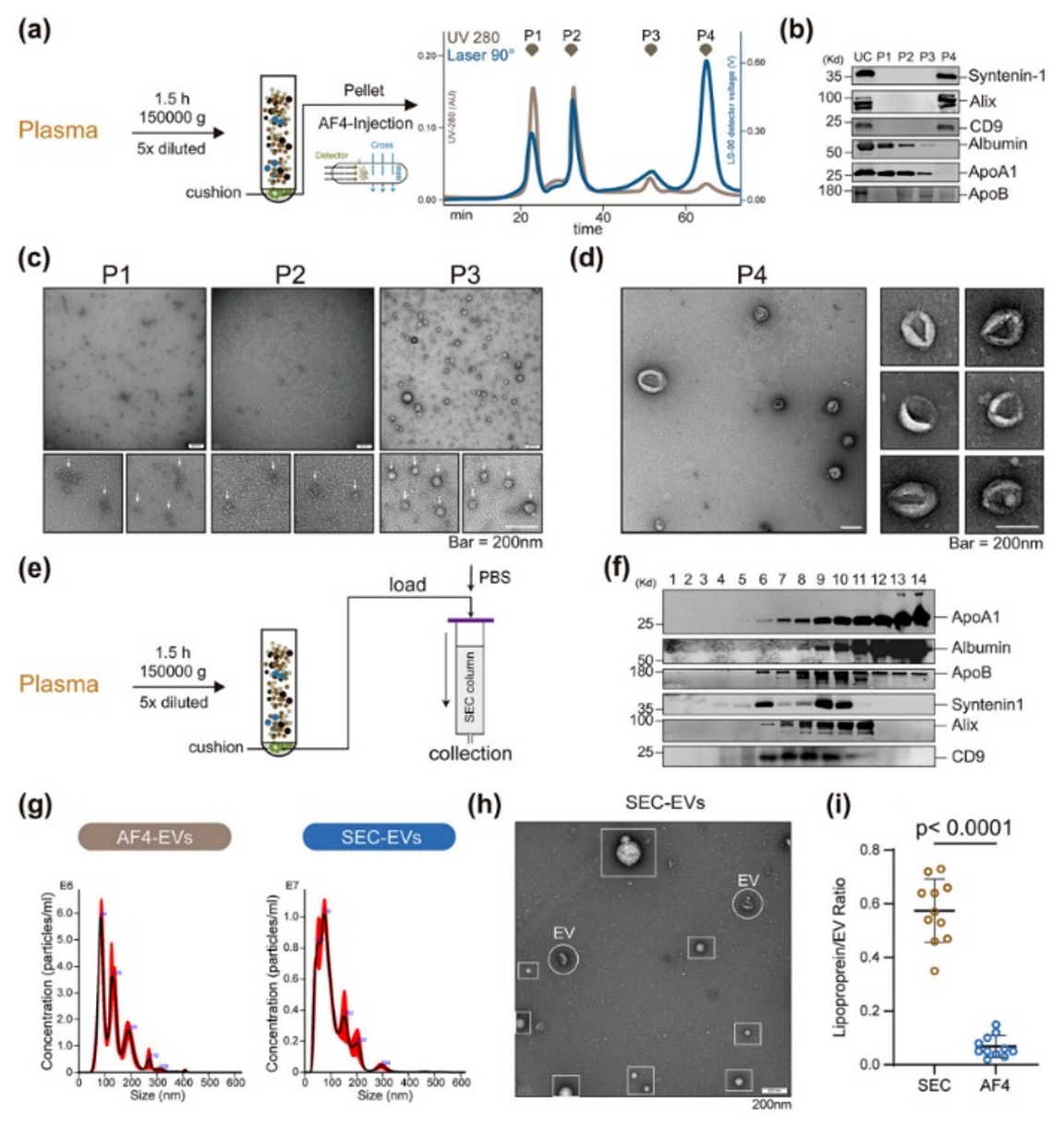
细胞外囊泡(Extracellular Vesicles, EVs)因其在细胞间通信中的关键作用和作为潜在疾病生物标志物的应用前景,近年来备受关注。然而,从血液样本中分离EVs的过程常受到大量血浆蛋白的干扰,这对后续的生化分析带来了挑战。近日,广州实验室徐涛院士/李总红团队在国际细胞外囊泡学会(ISEV)官方权威期刊Journal of Extracellular Vesicles(IF=16)上发表题为“Optimized AF4 combined with density cushion ultracentrifugation enables profiling of high-purity human blood extracellular vesicles”的文章(2024 Jul;13(7):e12470)。该研究通过优化后的非对称流动场流分离(Asymmetric Flow Field-Flow Fractionation, AF4)结合密度垫超速离心(Density Cushion Ultracentrifugation, DCU)技术,从人血浆和血清中分离获得高纯度高质量的EVs,减少脂蛋白和其他非EVs污染物的干扰。胡立桥副研究员及华中科技大学联合培养博士生郑欣悦为该论文的第一作者。
这项研究通过优化的AF4结合DCU技术,显著提高了从人血浆中分离EVs的纯度,减少了脂蛋白和其他非EV成分的污染,从而更准确地进行下游分析。这种高纯度分离技术不仅有助于更好地理解血液循环EVs的生物学功能,还为EVs作为疾病生物标志物的开发提供了重要支持。随后作者对分离获得的血浆EVs和纳米颗粒(NPs)进行全面的组学分析,并鉴定一系列全新血浆EV标志物(如MYCT1和TSPAN14等),也进一步表明部分传统细胞来源EV标志物已不适用描述血浆EVs。值得注意的是,近期Nature杂志发表一篇报道称,MYCT1定位于内体膜,参与细胞内囊泡运输,对人类造血干细胞的功能至关重要。同时,作者获取了健康人群高纯度血浆EVs 的miRNA表达数据,为进一步研究EVs在生理和病理状态中的作用提供了宝贵资源。最后,作者系统对比了血浆和血清来源的EVs异同,首先二者在AF4中的分离行为十分类似,但血浆EVs包含更多的可被检测的膜相关蛋白,可能更适用于临床应用的选择。Optimized AF4 combined with density cushion ultracentrifugation enables profiling of high-purity human blood extracellular vesicles. Journal of Extracellular Vesicles. 2024 Jul;13(7):e12470. https://doi.org/10.1002/jev2.12470.外泌体资讯网 JEV|广州实验室徐涛院士/李总红团队:利用优化后的非对称场流分离(AF4)与超速离心联合使用,全面剖析血液细胞外囊泡形态与构成