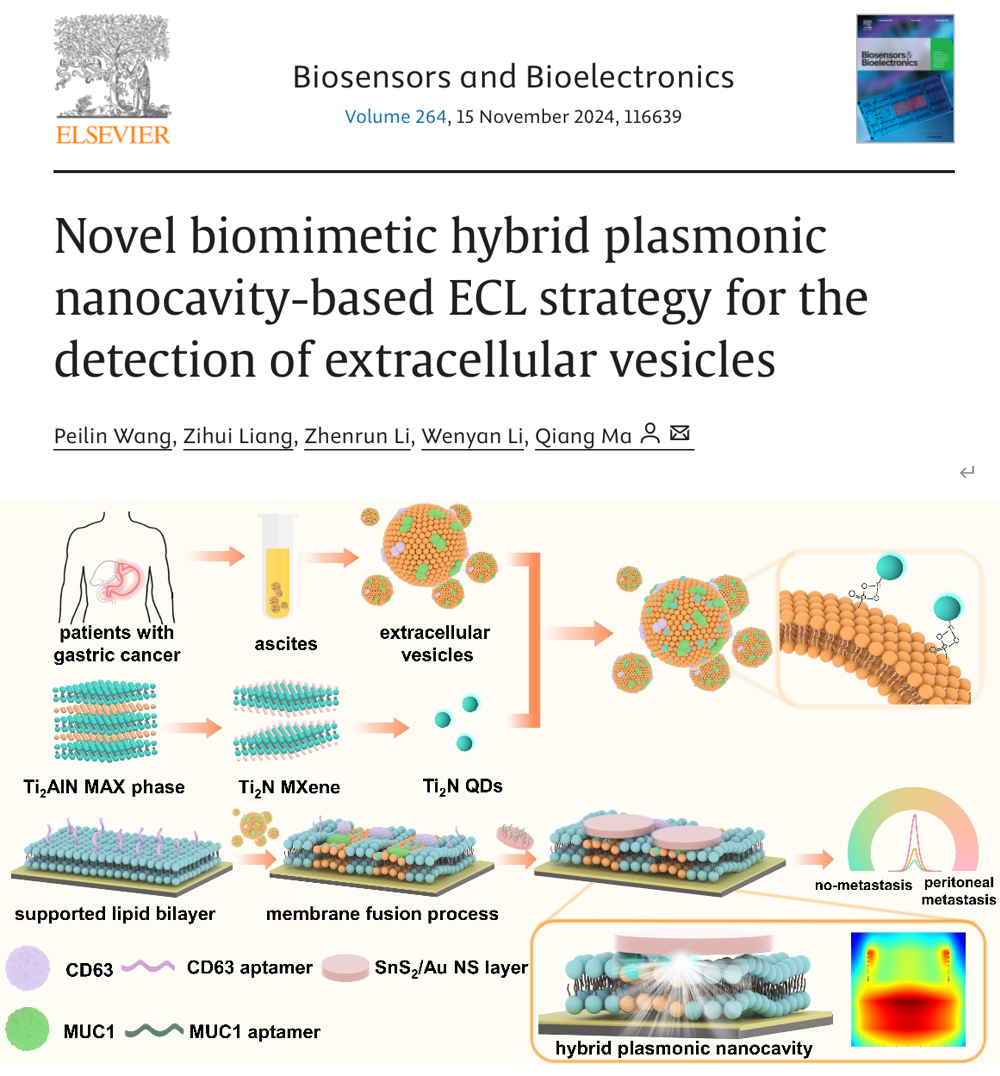
肿瘤细胞分泌的细胞外囊泡(EVs)携带大量生物分子参与肿瘤发生、发展及转移过程,作为重要的液体活检方法,患者体液中EVs的检测为癌症的临床诊断和监测提供了重要的诊疗指标。当前针对EVs的检测方法主要集中于对单一生物标志物的识别,导致对复杂临床样本的分析难以反映真实病理生理情况。磷脂双分子层以其固有的结构特征和生物膜功能特性,有利于作为标记位点并辅助构建功能结构,提高对EVs的识别和检测效率,为EVs表面肿瘤相关蛋白的分析提供帮助。
近日,吉林大学马强教授团队在Biosensors and Bioelectronics杂志上发表题为“Novel biomimetic hybrid plasmonic nanocavity-based ECL strategy for the detection of extracellular vesicles”的研究论文(2024 Aug 8:264:116639)。通过设计工程化仿生磷脂膜,并结合膜融合策略构建基于杂化等离子体纳米腔的电化学发光(ECL)传感体系,实现了对胃癌患者腹水中细胞外囊泡的灵敏检测,同时对胃癌腹膜转移情况进行了精确评估。论文第一作者为博士研究生王培琳,通讯作者为马强教授。
图1. 基于杂化等离子体纳米腔的ECL传感体系检测腹水中EVs示意图这一研究工作中,以MXene衍生Ti2N量子点作为ECL纳米发光探针并通过其表面Ti原子与EVs磷脂结合以标记EVs,以六方金纳米片阵列结构与金纳米薄层包覆的SnS2纳米片(SnS2/Au NS layer)作为结构单元构建杂化等离子体纳米腔。在电极表面设计了CD63适配体修饰的仿生磷脂双层,能够有效捕获Ti2N量子点标记的EVs并触发膜融合过程。通过对EVs表面胃癌标志物MUC1蛋白的特异性识别连接SnS2/Au NS layer形成纳米腔结构,纳米腔区域电磁场强度显著增强,实现在特定偏振角下显著增强ECL信号。所提出的ECL传感体系实现了在胃癌患者腹水中对MUC1阳性EVs的灵敏检测。结合临床诊断信息分析,EVs检测结果能够成功区分胃癌分期,胃癌腹膜转移患者腹水样本中EVs表达量明显增加。ROC曲线显示对EVs的检测能够准确评估胃癌腹膜转移情况(AUC=0.967),分析总体准确率为81%。
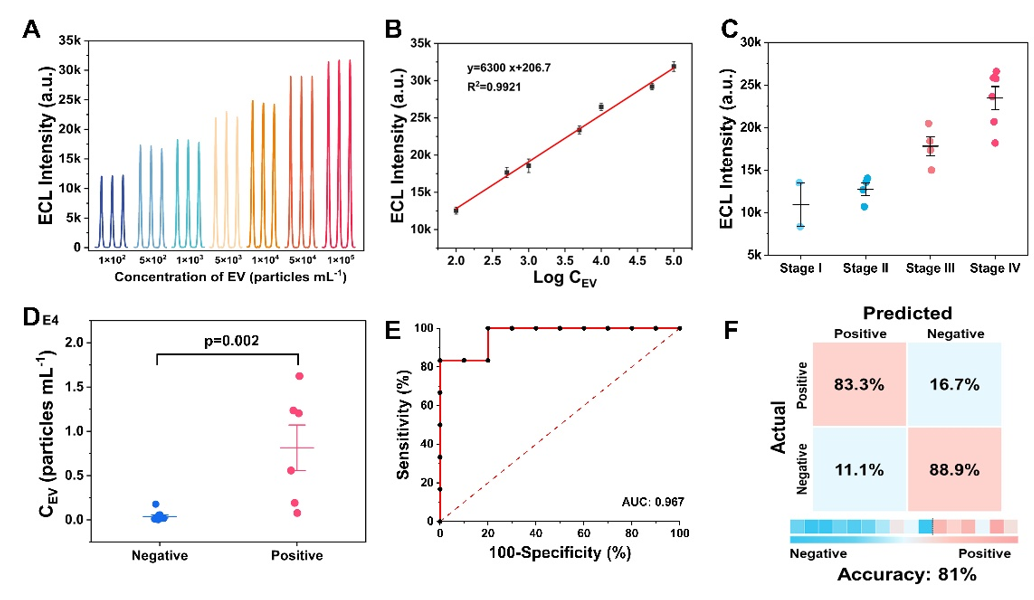
图2. ECL传感体系对MUC1阳性EVs的检测性能及对胃癌患者腹水样本的分析结果结果表明,此项研究工作所建立的ECL传感体系在EVs识别过程中同时完成光学纳米功能结构构建,为EVs检测提供了高度局域的传感区域。实现了针对胃癌EVs的高灵敏、高特异性检测,能够成功判断胃癌腹膜转移情况,表现出在液体活检中的潜在应用价值。参考文献:Novel biomimetic hybrid plasmonic nanocavity-based ECL strategy for the detection of extracellular vesicles, Biosensors and Bioelectronics 264(2024) 116639. DOI: 10.1016/j.bios.2024.116639.
外泌体资讯网 Biosens Bioelectron |吉林大学马强团队:基于新型仿生杂化等离子体纳米腔的电化学发光策略对细胞外囊泡的检测研究