抗体-偶联药物(ADCs)已成为恶性肿瘤治疗的有效策略。ADCs由一个特异性结合肿瘤细胞膜上目标受体的抗体、一个具有高抗肿瘤活性的细胞毒药物以及连接这两部分的可切割或不可切割的连接子组成。然而,传统的ADCs通过细胞毒性载荷进行化疗来抑制肿瘤生长,缺乏肿瘤靶向免疫治疗的能力。虽然现在已经有在开发针对肿瘤靶向免疫疗法的抗体药物偶联物(iADC),如STING激动剂被用作抗体的药物载荷,具有激活抗肿瘤免疫的能力。然而,单一的治疗方式(如化疗或免疫疗法)限制了这些ADC药物的应用。而化疗和免疫疗法的整合是肿瘤治疗中最有希望的策略之一。因此,开发一种具有免疫疗法和化疗协同效应的新型治疗对肿瘤治疗具有重要意义。近日,四川大学华西医院郭应强教授/杨涛副研究员团队在Journal of Medicinal Chemistry杂志上发表题为“Advancing Tumor-Targeted Chemo-Immunotherapy: Development of the CAR-M-derived Exosome-Drug Conjugate”的论文。文章的第一作者姜云翰博士和徐小秋博士,通讯作者为郭应强教授和杨涛副研究员。
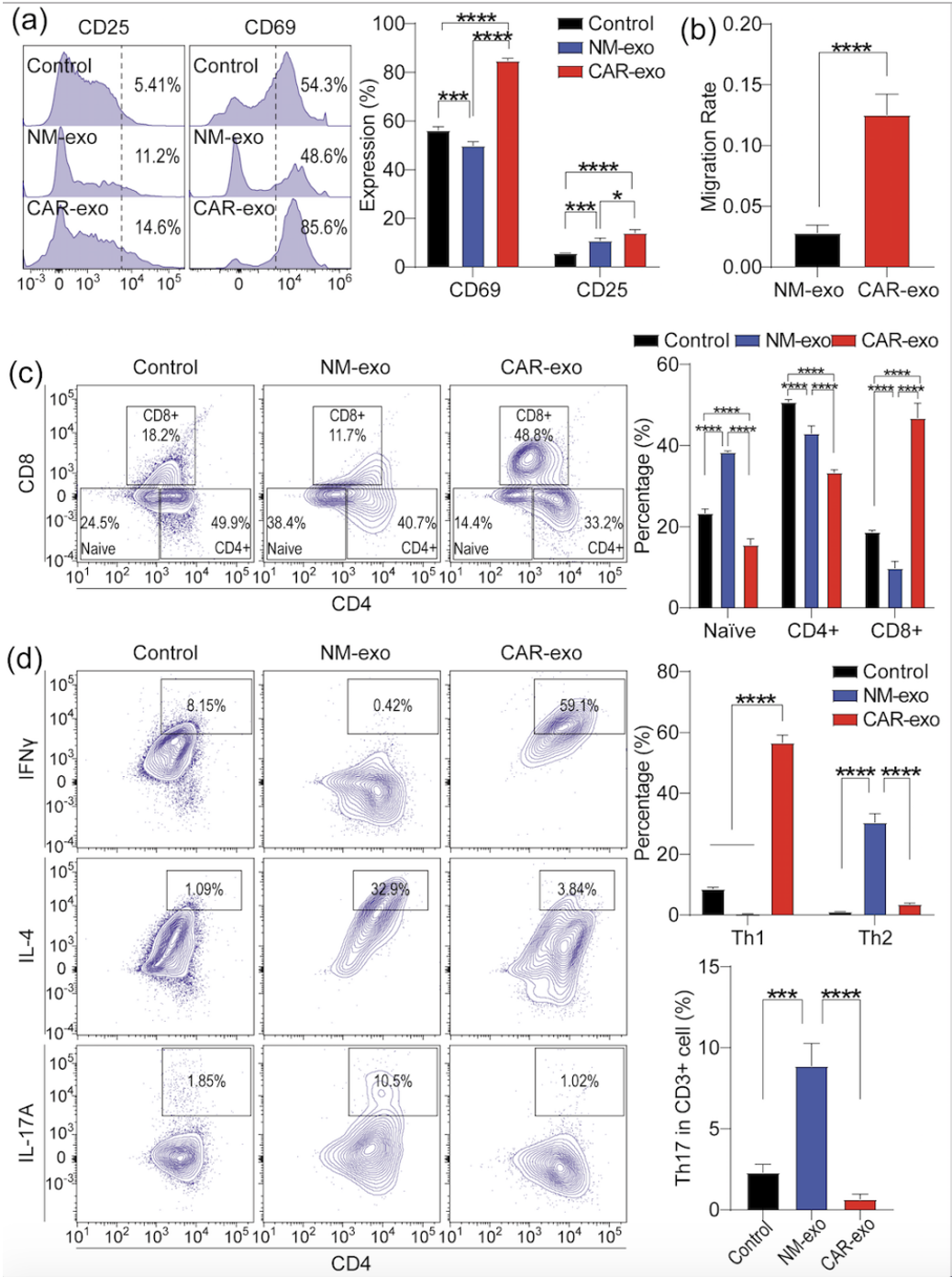
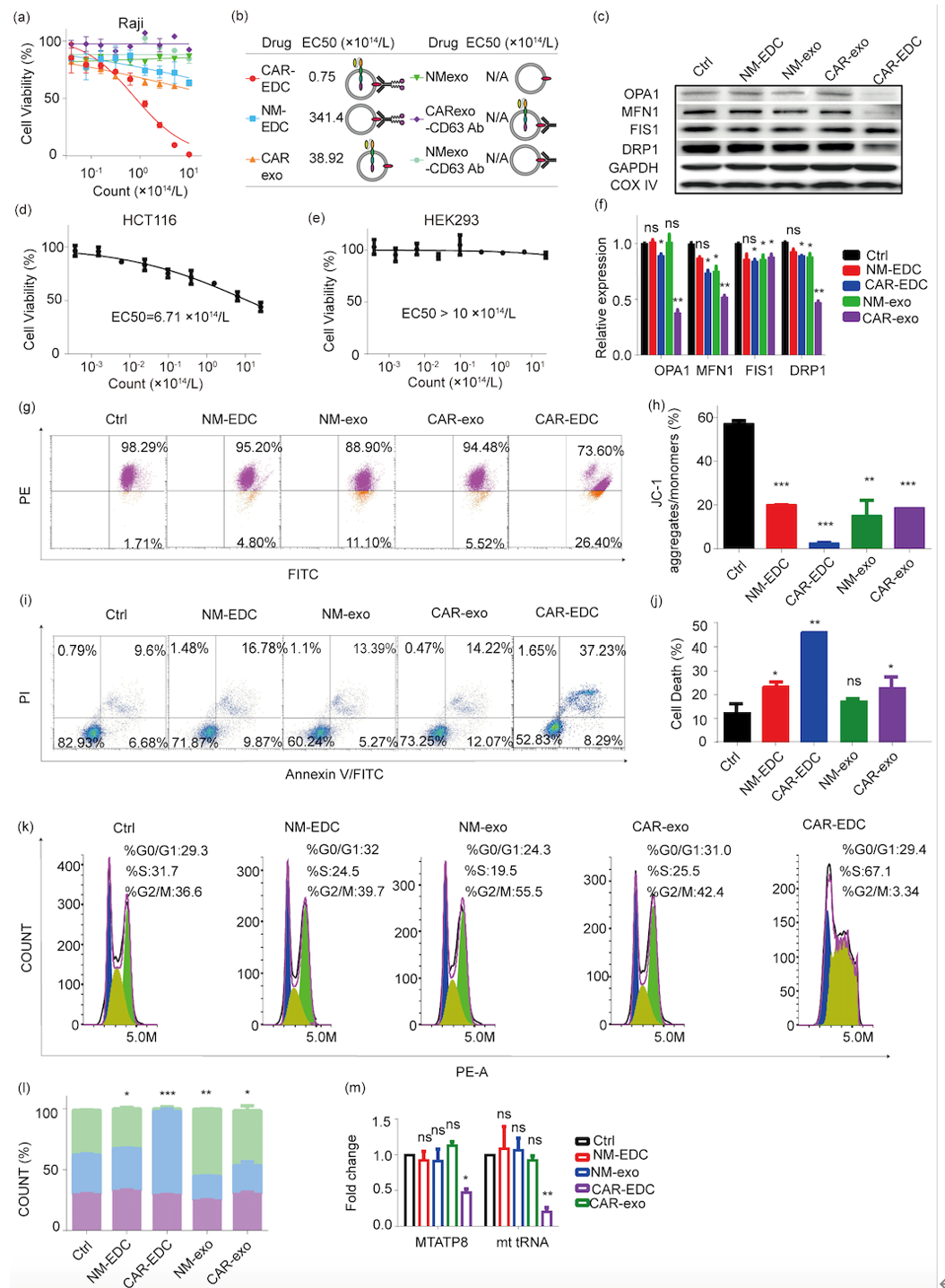
在这项研究中,作者发现来自CAR-巨噬细胞(靶向CD19)的外泌体含有较高水平的CXCL10,这是一种在免疫反应中发挥关键作用的趋化因子。因此,作者开发了一个新的平台CAR-EDC(CAR-M来源的外泌体-药物偶联物),用于肿瘤靶向的化学-免疫疗法。在这个偶联物中,CAR-M来源的外泌体(CAR-外泌体)被用作药物载体,通过pH敏感的连接子共价装载细胞毒性载荷SN-38。CAR-EDC的肿瘤靶向效果是通过CAR分子与Raji细胞上的CD19特异性结合来实现的。然后,通过微囊泡吞噬和clathrin介导的内吞作用将SN-38输送到肿瘤细胞中。总的来说,CAR-EDC通过SN-38的化疗和CXCL10介导的激活抗肿瘤免疫的免疫疗法,发挥了抗肿瘤作用。值得注意的是,作者开发的该靶向治疗策略将在未来被应用到其他疾病的治疗中,如心血管疾病等。作者设计、制备、表征CAR-M来源的外泌体,证明其含有高水平的CXCL10。基于该外泌体,作者构建了CAR-外泌体-药物偶联物(CAR-EDC)。这种新型偶联物通过由CAR分子介导的内吞作用迅速进入Raji细胞。CAR-EDC内在的趋化因子CXCL10可以激活T淋巴细胞和巨噬细胞的抗肿瘤免疫(如下图)。CAR-EDC通过释放装载的细胞毒性药物在体外和体内显著抑制了Raji细胞。然而对无CD19低表达的细胞无明显抑制作用。CAR-EDC通过抑制线粒体功能来抑制肿瘤形成和发展(如下图)。综合来看,这项研究因此提供了一种可推广的化学免疫疗法策略,该策略使用CAR-外泌体作为药物载体,特异性地将细胞毒性载荷输送到肿瘤细胞中,并激活由CXCL10介导的免疫反应,从而显示出协同的抗肿瘤效果并最小化潜在的副作用。该靶向治疗策略将在未来被应用到其他疾病的治疗中,如心血管疾病等。Advancing Tumor-Targeted Chemo-Immunotherapy: Development of the CAR-M-derived Exosome-Drug Conjugate. Journal of medicinal chemistry, 2024 10.1021/acs.jmedchem.4c00753.外泌体资讯网 J Med Chem|四川大学华西医院郭应强/杨涛:一种CAR-M来源外泌体-药物偶联物的构建以及其肿瘤靶向的化疗-免疫治疗研究