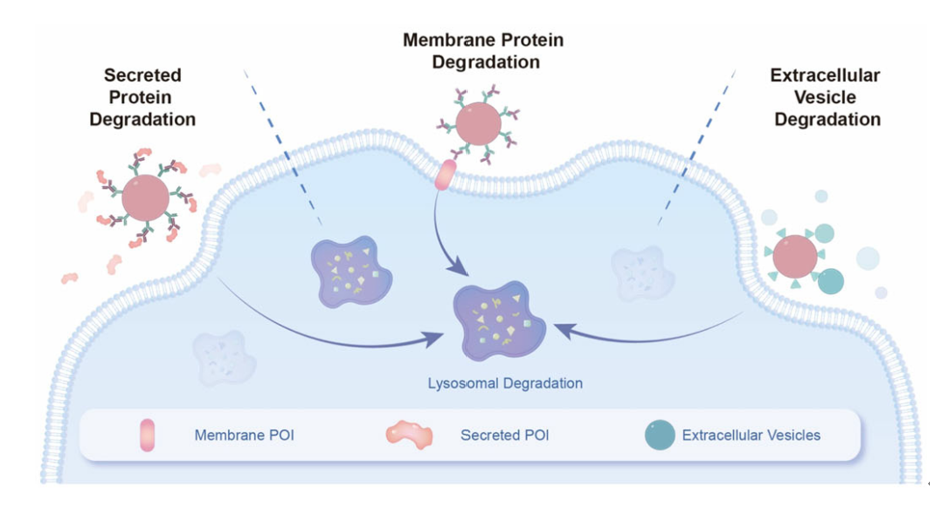
靶向蛋白降解(TPD)是一种有效的诱发目标蛋白降解并选择性消除致病蛋白的方式。近年来以PROTAC和分子胶为代表的TPD技术的研究如火如荼,这些技术主要降解具有胞内结构域的蛋白。很多胞外蛋白,比如生长因子、趋化因子等,它们在多种疾病(如帕金森病、癌症等)中引发异常的信号传导,目前针对胞外蛋白降解的策略主要依赖于双功能嵌合体来实现。然而,这种“双功能型”靶向降解平台需要依赖特定的受体(如溶酶体转运受体LTR,包括CI-M6PR、ASGPR等)或跨膜E3连接酶(RNF43、ZNRF3等)将POI转运到溶酶体内进行降解,这种依赖性可能会导致潜在的耐药性问题。
大量研究表明,纳米材料(如聚合物纳米颗粒和脂质纳米颗粒)在无配体修饰的情况下,能够被细胞高效内吞并运输到溶酶体,为非特定受体依赖的“单功能型”靶向降解平台的发展提供了启示。
近日,浙江大学邵世群研究员、刘坚研究员及相佳佳研究员合作团队在Nature Communications发表了题为”A plug-and-play monofunctional platform for targeted degradation of extracellular proteins and vesicles”的研究论文(2024 Aug 22;15(1):7237),主要介绍了一种“单功能型”靶向降解平台MONOTAB(MOdified NanOparticle with TArgeting Binders),并证实了该平台有效降解多种治疗靶点,如膜蛋白PD-L1、分泌蛋白MMP2以及非蛋白靶标(细胞外囊泡)。 浙江大学博士生姚莎莎、王毅博士和博士生唐倩为文章的共同第一作者,浙江大学邵世群研究员为最后通讯作者,刘坚研究员和相佳佳研究员为共同通讯作者。
在该研究中,作者以链霉亲和素修饰的聚合物纳米颗粒(NPs)为核心,利用亲和素与生物素之间特异性非共价作用偶联生物素化的抗IgG抗体,形成αFc-NP复合物,再通过二抗与一抗之间的免疫识别作用,将可结合目标蛋白(POI)的一抗连接到αFc-NP表面形成可以降解胞外蛋白的MONOTAB(αPDL1-NP、αMMP2-NP);或直接将生物素化的目标蛋白结合物偶联到纳米颗粒表面形成可以降解细胞外囊泡的MONOTAB(Annexin V-NP),如图1所示。
图1. MONOTAB介导胞外蛋白和细胞外囊泡降解
作者先证实了NPs的溶酶体靶向性和非特定受体依赖性,抗体修饰后溶酶体的靶向性不发生变化。随后,作者在膜蛋白PD-L1和分泌蛋白MMP2模型上证明了αPDL1-NP与αMMP2-NP的蛋白降解能力。
细胞外囊泡(EV)参与多种疾病的病理过程,同时在正常的生理过程中也发挥着介导细胞间通讯的重要功能,但此前未曾报道过EV的选择性降解技术。由于EV缺乏特异性的靶向蛋白,作者巧妙地利用了磷脂酰丝氨酸暴露在细胞外囊泡上但不存在于正常细胞表面这一特性,将生物素修饰的Annexin V偶联到NPs的表面,成功构建了相应的MONOTAB — Annexin V-NP。Annexin V-NP能够通过Annexin V与磷脂酰丝氨酸之间的强相互作用,将细胞外囊泡(稳转EGFP)“拖”至溶酶体,并在其中进行降解(图2)。

图2. Annexin V-NP降解细胞外囊泡
肿瘤细胞释放的细胞外囊泡会对机体细胞产生炎症反应、促进细胞迁移、增强药物抵抗等不利影响。选择性降解细胞外囊泡提供了一种别样的治疗方式,有望成为治疗和研究应用的强大工具。
参考文献:Yao, S., Wang, Y., Tang, Q. et al. A plug-and-play monofunctional platform for targeted degradation of extracellular proteins and vesicles. Nat Commun 15, 7237 (2024). https://doi.org/10.1038/s41467-024-51720-z
外泌体资讯网 Nat Commun|浙江大学邵世群/刘坚/相佳佳:“即插即用”型单功能靶向降解平台MONOTAB用于胞外蛋白和细胞外囊泡的降解