心肌梗死(MI)是一种严重的缺血性心脏病。数十年来,针对心肌梗死后心脏修复的干细胞疗法显示出有限的疗效,并受到多种限制的制约,例如不理想的生物分布和植入、难以捉摸的治疗机制,以及不可避免的肿瘤发生和免疫原性风险。已知成年干细胞主要通过分泌旁分泌因子,包括细胞外囊泡,发挥其有益作用。其中,外泌体的大小范围为40到160纳米,在临床前研究和早期临床试验中被广泛研究,并显示出通过miRNA介导的信号通路调节对心肌修复的再生效果。然而,与细胞不同,外泌体在体内的半衰期较短,为达到治疗效果,需要反复给药。至今尚未开发出一种安全、有效、可重复的心脏修复外泌体递送方法,这对于临床转化的成功至关重要。近日,美国哥伦比亚大学生物医学工程系的程柯教授带领团队在心血管领域顶尖杂志Circulation上发表文章,报道了一种名为SCENT (Stem Cell-derived Exosome Nebulization Therapy)的无创性外泌体递送方法,可通过重复的雾化吸入来治疗梗死后的心脏。
在作者之前的研究中,肺类球细胞(LSC)衍生的分泌物/外泌体(LSC-Exos)通过吸入递送在啮齿动物和非人灵长类动物中显示出安全性和极大的再生潜力,促进了抗纤维化和改善血管化。此外,研究证明了LSC-Exos在冷冻储存前后的稳定性,这为将这些外泌体作为即用型疗法进行吸入递送提供了鼓舞。LSC及其衍生产品已获准进入呼吸系统疾病的I期临床试验。在对LSC-Exos进行RNA测序时,我们发现了多种可有益于心脏病的治疗性miRNA。基于这些初步工作,研究团队希望进一步探索LSC-Exos在心脏治疗中的可行性。因此,该研究开发了用于心脏修复的干细胞衍生外泌体雾化疗法(SCENT),并在小鼠心肌梗死模型中确认了其疗效,通过单细胞RNA测序确定了关键机制。随后,在转基因小鼠模型中验证了该发现,并扩大规模在猪中进行测试。研究摘要:
- 背景:外泌体疗法在心脏损伤后的修复中显示出潜力。然而,固有挑战如半衰期短和缺乏明确靶点阻碍了其临床可行性。该研究报告了一种在心肌梗死(MI)后通过吸入递送外泌体的非侵入性和可重复的方法,称为干细胞衍生外泌体雾化疗法(SCENT)。
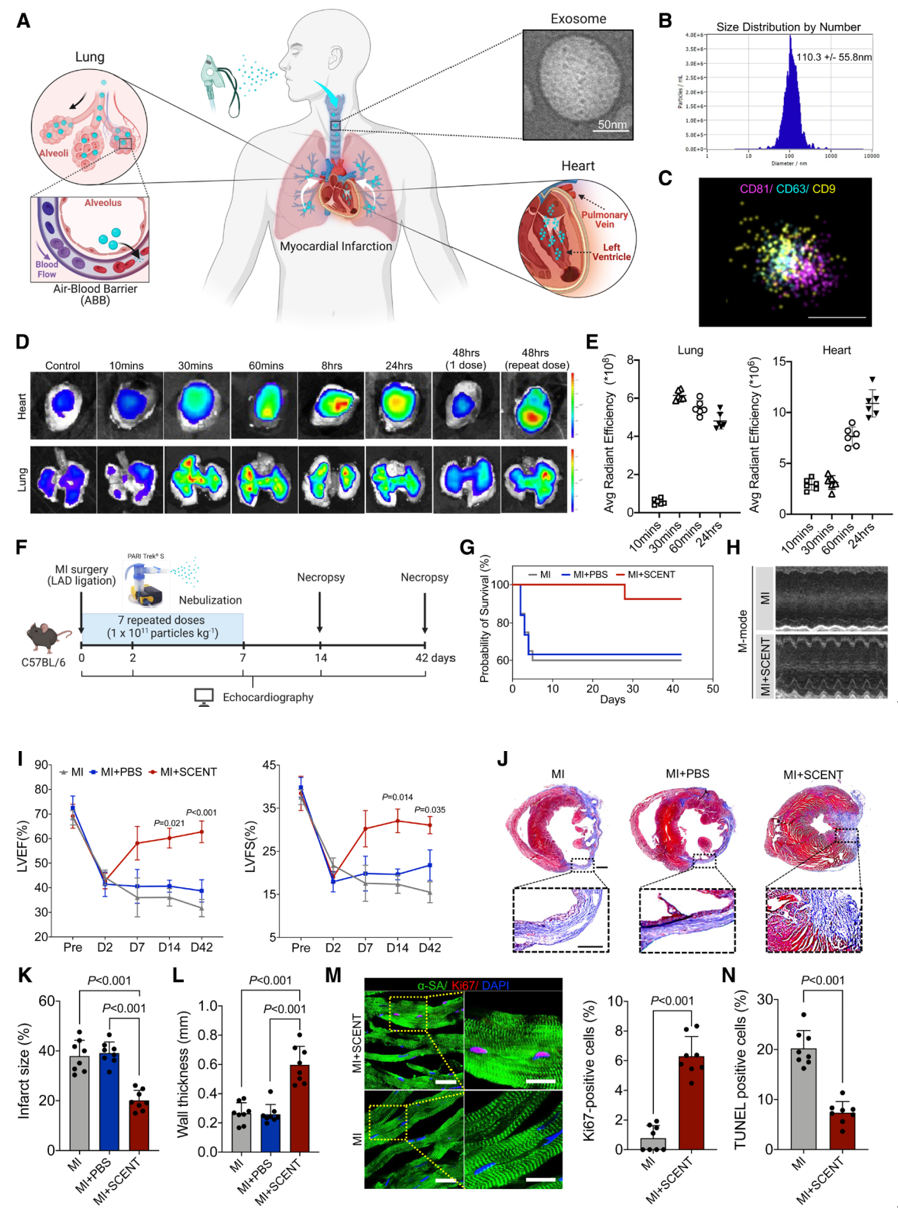
- 方法:对干细胞衍生外泌体的尺寸分布和表面标记进行了表征。心肌梗死模型的C57BL/6小鼠通过雾化器连续7天接受外泌体吸入治疗。通过心脏超声检查监测SCENT后的心脏功能,并通过组织学分析研究心肌修复。对整个心脏进行单细胞RNA测序以探索SCENT的作用机制。最后,在猪的心肌梗死模型中通过三维心脏磁共振成像展示了SCENT的可行性、有效性和一般安全性。
- 结果:通过离体IVIS成像和荧光显微镜检测到SCENT后外泌体向缺血性心脏的募集。在小鼠心肌梗死模型中,SCENT通过改善左心室功能、减少纤维化组织和促进心肌细胞增殖改善了心脏修复。SCENT后小鼠心脏的单细胞RNA测序机制研究揭示了内皮细胞(ECs)中Cd36的下调。在EC-Cd36fl/-条件性敲除小鼠模型中,抑制ECs中的脂肪酸转运蛋白CD36导致心脏葡萄糖利用的补偿性增加和更高的ATP生成,从而增强心脏收缩力。在猪中,与对照相比,SCENT治疗后心脏磁共振成像显示心肌梗死后28天射血分数(Δ=11.66±5.12%)和短轴缩短率(Δ=5.72±2.29%)增强,梗死面积减少,心室壁变厚。
- 结论:在啮齿动物和猪模型中,该研究数据证明了SCENT治疗急性心肌梗死损伤的可行性、有效性和一般安全性,为临床研究奠定了基础。此外,EC-Cd36fl/-小鼠模型首次提供了条件性EC-CD36敲除可以改善心脏损伤的体内证据。该研究引入了一种心脏病非侵入性治疗选择,并确定了新的潜在治疗靶点。
SCENT对MI损伤小鼠的可行性和治疗效果该研究展示了SCENT疗法的有效性,即通过雾化器将干细胞衍生外泌体(LSC-Exos)递送至远端肺部,再通过肺泡-毛细血管屏障进入循环系统,最终通过肺静脉到达缺血性心脏。研究首先对外泌体的形态、尺寸和表面标记进行了表征,并通过离体IVIS成像研究了外泌体在小鼠体内的生物分布。结果显示,吸入的外泌体在吸入后10到60分钟内快速分布于肺部,并在60分钟后开始在心脏积累,与此同时,肺部信号减少,表明外泌体通过血液循环从肺部进入心脏。重复给药提高了外泌体在心脏中的保留率。在心肌梗死(MI)的小鼠模型中,研究发现SCENT治疗组的存活率显著高于对照组。心脏功能评估显示,无论是短期(1周和2周)还是长期(6周),SCENT组的左心室(LV)功能均高于对照组,表明吸入外泌体具有显著的治疗效果。此外,组织学研究显示SCENT显著减少了纤维化组织并增厚了可存活的LV壁,减轻了心脏纤维化和不良重构。组织学分析还发现,SCENT治疗后MI心脏中Ki67+、Cyclin D2+、Aurora A+和Aurora B+细胞核增加,表明心肌细胞增殖增加。在体外,培养于外泌体中的心肌细胞显示出更高的增殖水平。此外,TUNEL分析显示,SCENT治疗后MI心脏中凋亡的心肌细胞减少。这些结果表明,SCENT疗法促进了心脏重构的进展。为了评估SCENT的安全性,研究检查了其他器官的免疫反应和毒性。结果显示,SCENT治疗未引发肺、脾、肝、肾等器官的毒性或炎症反应,血液测试也未显示肝肾功能的显著差异,证明SCENT对小鼠的肝肾无副作用。肺功能指标在治疗组与对照组之间也无显著差异。总体而言,SCENT疗法在MI小鼠中表现出良好的安全性和有效性,为其临床应用奠定了基础。
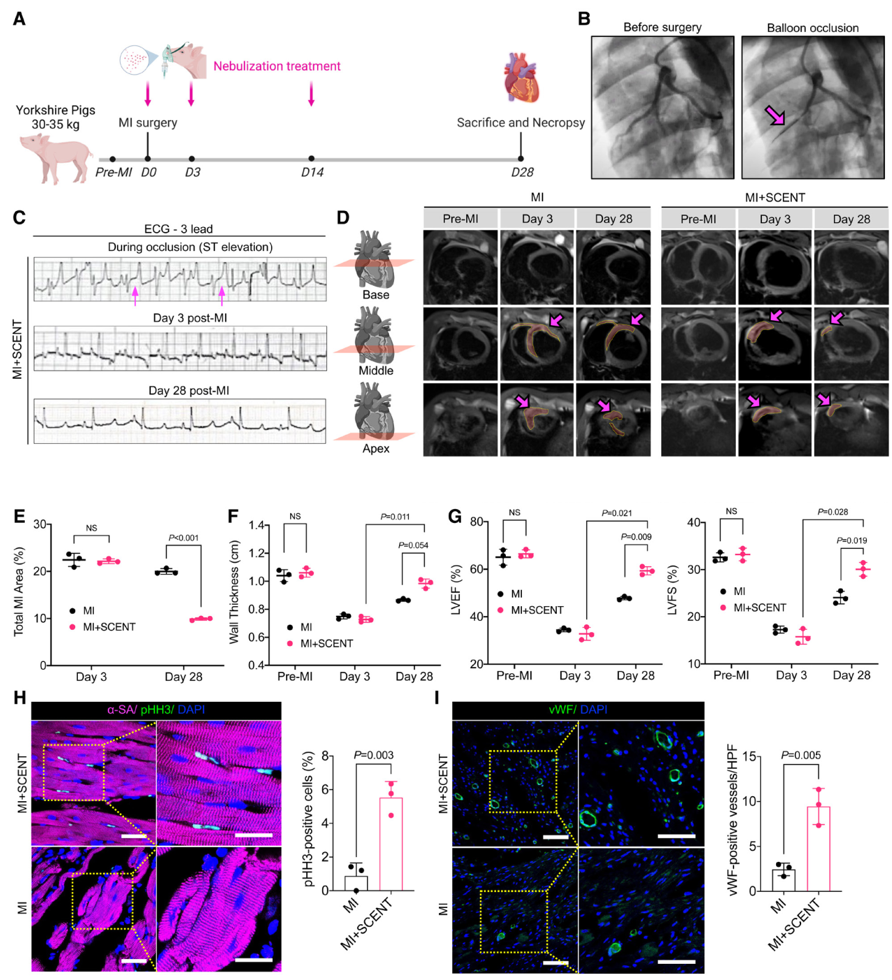
SCENT为患有缺血性心脏损伤的猪提供心脏保护该研究通过气囊阻塞建立了猪缺血/再灌注模型,以模拟临床情况,并通过氧气面罩进行外泌体雾化。血管造影和心电图显示了成功的左前降支动脉阻塞及急性缺血的典型表现。MI后第3天,心电图显示梗死迹象,并通过猪血清中高水平的肌钙蛋白I证实。第28天,SCENT治疗的心脏心电图恢复正常,显示缺血改善。通过三维MRI评估心脏功能恢复,SCENT治疗组在第28天显示较小的梗死区,与第3天相比,SCENT显著减少了心肌梗死面积,增厚了左心室壁,增强了心室收缩能力。射血分数和缩短率在SCENT组明显高于对照组,显示出更强的心脏收缩力。组织学研究发现SCENT促进了心肌细胞增殖和血管密度增加。关于SCENT在猪中的生物安全性,所有动物在研究终点均存活,且未见明显异常。炎症因子的检测表明,SCENT未引起显著的免疫反应,血液学和肝肾功能指标与基线无显著差异。综上所述,SCENT治疗在临床相关的大动物模型中是安全有效的,显示出其向临床应用转化的潜力。总之,该研究为探索可吸入外泌体作为MI患者一种有前景且有效的治疗方式铺平了道路。这些研究结果的汇集,基于先前学术资源的基础,标志着心脏再生干预领域的显著进展。参考文献:Li J, Sun S, Zhu D, Mei X, Lyu Y, Huang K, Li Y, Liu S, Wang Z, Hu S, Lutz HJ, Popowski KD, Dinh PC, Butte AJ, Cheng K. Inhalable Stem Cell Exosomes Promote Heart Repair After Myocardial Infarction. Circulation. 2024 Aug 27;150(9):710-723. doi: 10.1161/CIRCULATIONAHA.123.065005. Epub 2024 Aug 26. PMID: 39186525; PMCID: PMC11349039.