外泌体是一种广泛存在于体液中直径为40至160纳米的细胞外囊泡。由于不同类型的肿瘤通常在外泌体表面表达特异性膜蛋白,因此外泌体被认为是重要的癌症生物标志物并在液体活检领域引起了极大的研究兴趣。传统的免标记检测方法依赖于昂贵的抗体功能化等离激元超表面,而适配体因其低成本和小体积的优势,展现出替代抗体的潜力。然而,基于适配体的外泌体等离激元超表面共振传感研究目前仍处于探索阶段。
近日,厦门大学朱锦锋教授团队在Advanced Optical Materials杂志上发表题为“Exploring Aptamer-Based Metasurfaces for Label-Free Plasmonic Biosensing of Breast Tumor-Derived Exosomes”的论文。该研究深入探讨了不同适配体功能化方法对等离激元超表面生物传感器性能的影响,并揭示了外泌体检测灵敏度的近场增强机制。在此基础上,团队开发了一种基于适配体检测外泌体膜蛋白(如上皮细胞粘附分子EpCAM和人表皮生长因子受体2(HER2))的等离激元超表面(APM)生物传感器。通过对临床血清样本中外泌体的检测,该传感器实现了对乳腺癌(BC)患者的高灵敏度诊断。研究表明,APM生物传感器为外泌体的临床检测提供了一个可靠便捷的平台,有望在癌症诊断中发挥重要作用。厦门大学2024届硕士生胡荣盛和厦门大学附属第一医院核医学科林少唯主任技师为文章共同第一作者,通讯作者为厦门大学朱锦锋教授。
图1:核酸适配体功能化等离激元超表面的乳腺癌外泌体生物传感示意图
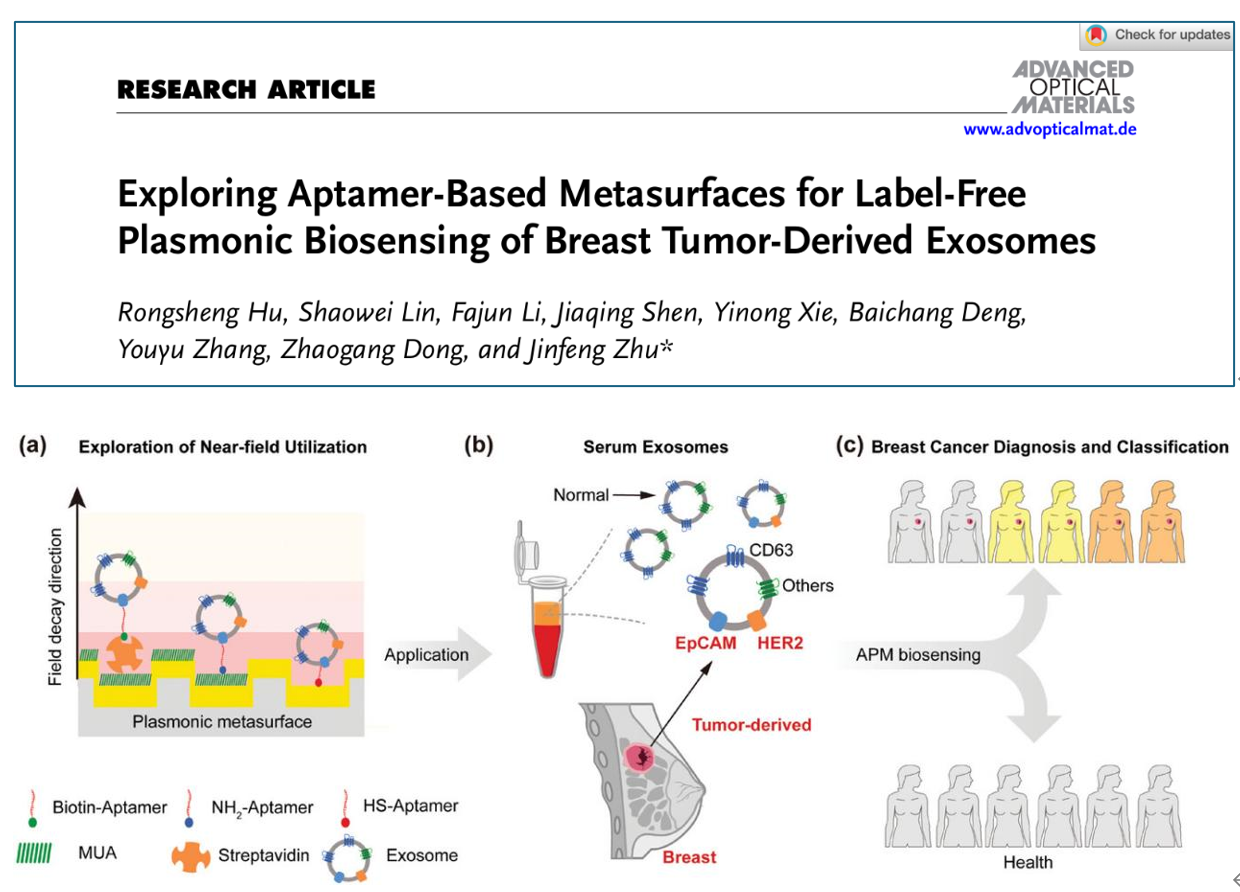
团队采用纳米压印和磁控溅射技术制备出均匀的六角蜂窝型金纳米孔阵列超表面,并通过光学仿真建模探究了APM的光学近场传感机理。研究表明,光场在纳米孔洞周围高度集中,形成了显著的“热点”。然而,随着超表面生物功能化层厚度的增加,表面灵敏度急剧下降。相反,在生物功能化层较薄时,外泌体能够占据更大的近场增强区域,从而显著提升传感性能。通过近场效应对外泌体传感的物理分析,该研究阐明了超表面生物功能化层的关键作用,为后续的超表面生物传感实验提供了重要的理论指导。
基于超表面的理论和建模研究,团队利用表面等离激元的近场效应,通过检测周围介质折射率的变化来识别外泌体标志物。研究比较了三种不同适配体生物功能化方法下的超表面对外泌体的传感效率。与生物素-适配体和NH2-生物素-适配体功能化的等离激元超表面相比,采用HS-适配体的生物功能化步骤最少,形成最薄的生物功能化层并减少了近场空间的占用,其生物传感利用率达到了83.3%。因此,HS-适配体在这三种适配体固定功能化的超表面中表现出最佳的生物传感性能。利用HS-适配体功能化的超表面进行外泌体的传感曲线检测,其动态范围为1.16 × 105 ~ 1.83 × 107 particle /mL,检出限低至1.04 × 104 particle/mL,这一性能足以用于临床传感和诊断需求。

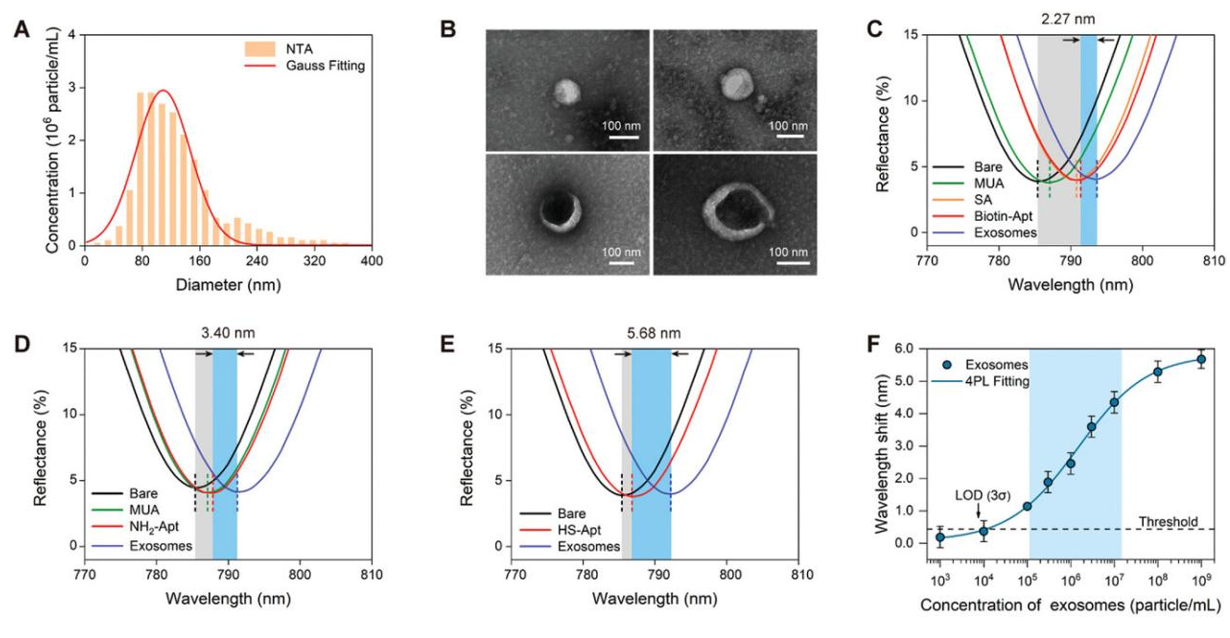
该研究将APM应用于乳腺癌的检测和诊断,通过EpCAM和HER2两种特异性膜蛋白对血清外泌体进行了生物传感检测。利用EpCAM和HER2特异性的适配体功能化的等离激元传感芯片,能够有效捕获血清中的外泌体,并表现出不同的光学偏移响应。纳米流式结果也证实了APM在EpCAM和HER2传感中的可靠性。APM生物传感信号能够有效反映血清样本的差异,并准确表示不同个体的外泌体水平差异,可以作为纳米流式检测的有效替代手段。在目前的临床诊断中,通过CT和MRI难以区分早期乳腺肿块的良恶性,而基于EpCAM的APM生物传感器可以明显区分良恶性患者,其t检验显示异常概率低至0.0001。研究评估了基于EpCAM的APM生物传感器在BC诊断中的表现,受试者的ROC曲线下面积(AUC)高达99.3%,显著优于常规血液学检测中生物标志物CA153的79.1%的AUC。此外,根据ASCO/CAP对HER2状态的评分标准,通常将BC患者分为4组,即HER2 0+、1+、2+和3+。这一BC分类可以通过基于HER2的血清外泌体APM生物传感器进行显著识别。t检验结果显示不同HER2水平组间的差异具有统计学意义。综上所述,通过APM检测EpCAM和HER2的血液学外泌体检测可以被认为是一种可靠而有力的方法,可以帮助临床诊断乳腺癌。
外泌体资讯网 Advanced Optical Materials|厦大朱锦锋团队:核酸适配体功能化超表面的乳腺癌外泌体快捷检测