胶质瘤是成年人中最常见的中枢神经系统肿瘤。目前的胶质瘤分类方案利用主要依赖于分子改变,特别是IDH1.R132H突变。通过传统的组织活检评估识别单核苷酸变异存在程序风险,并未完全反映异质性和不断发展的肿瘤景观。美国哈佛医学院麻省总医院的研究人员开发了一种液体活检检测——mt-IDH1dx,该基于血液的测试仅需2毫升血浆体积即可进行肿瘤来源的细胞外囊泡RNA的微创检测,并具备在监测和随访中的实用性,可提供有价值的预后信息。相关内容以“Clinical utility of a blood based assay for the detection of IDH1.R132H-mutant gliomas”为题在线发表于8月16日的国际知名综合性学术期刊Nature Communications杂志上。
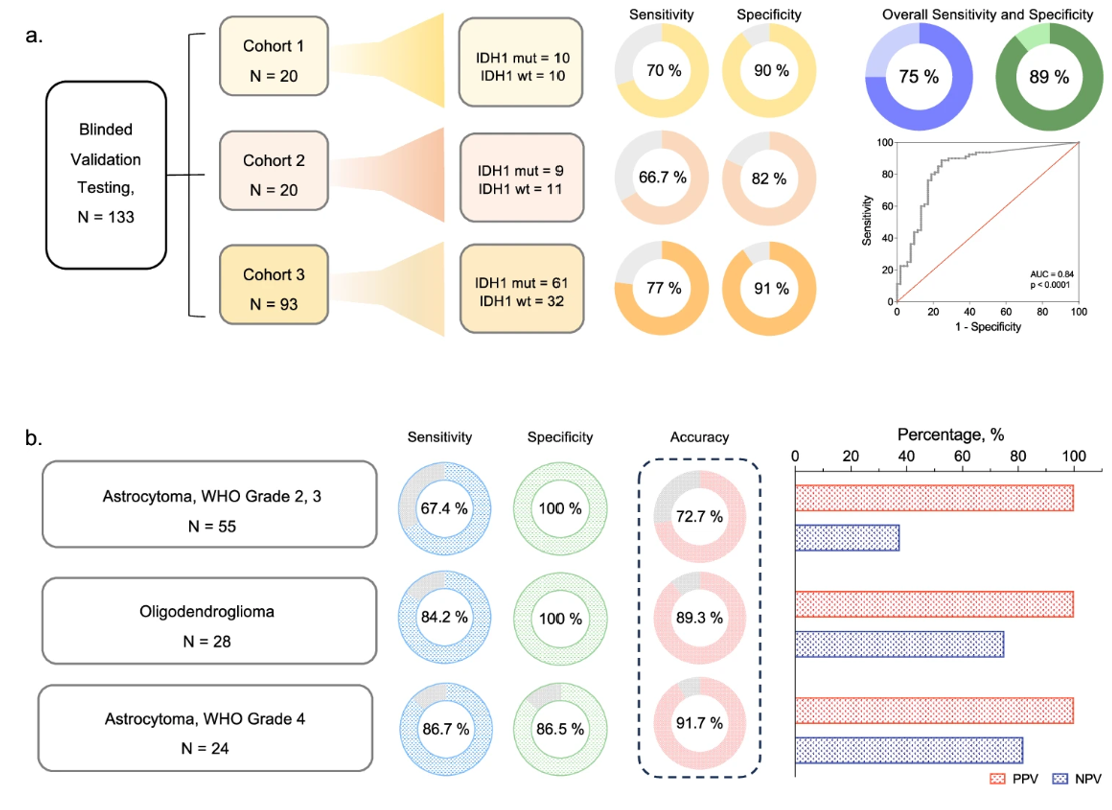
胶质瘤是成年人中最常见的原发性中枢神经系统(CNS)肿瘤,在美国总体发病率为每年每10万人中有6例胶质瘤。2021年世界卫生组织(WHO)脑肿瘤分类提供了一个新的框架,以基于组织学和独立的标志性分子改变对胶质瘤进行全面表征。重要的是,IDH1突变改变成为了一个关键的诊断生物标志物,存在于超过80%的WHO II/III级胶质瘤中,超过70%的继发性胶质母细胞瘤(GBM)中,以及不到10%的原发性GBM中(所有以前的IDH1突变GBM病变现在被归类为4级星形胶质瘤)。这一点突变发生在132号密码子,特征为在核苷酸位置395处的G>A转变(CGT>CAT),导致精氨酸被组氨酸替代。IDH1突变胶质瘤代表了一种独特的亚型,具有重要的临床意义,急切重要的是改善预后和生存结果。目前,神经影像学结合组织活检测试(外科活检/或肿瘤切除)是诊断IDH1突变胶质瘤的金标准。使用多种测试平台,具有不同的敏感性和覆盖深度,包括免疫组化(IHC)、基于DNA的PCR和二代测序(NGS)。从术中取样到诊断的周转时间约为2-3周。此外,除了具有侵入性外,外科组织活检还依赖于空间取样(病变边缘、核心)和足够且适当的组织可用性。最后,组织活检在纵向疾病监测和治疗监测中不能轻易重复。因此,通过这种方法进行基因检测非常局限,尤其是在跟踪治疗、外科干预或自然疾病进展而导致的动态、不断变化的分子特征方面。此外,最近的一项研究还报告了肿瘤组织活检对高等级胶质瘤的总体生存率产生不利影响,相较于“前期切除”。液体活检,定义为生物液体(血浆、脑脊液、尿液、唾液)的取样和分析,已成为快速、微创诊断包括胶质瘤在内的多种癌症的有前景的平台。这是通过分离和下游分析一系列循环肿瘤组织衍生的分析物来实现的,这些分析物密切反映了肿瘤细胞来源的表转录组特征:细胞外囊泡(EVs)、循环肿瘤细胞(CTCs)、游离DNA(cfDNA)和循环RNA。研究团队之前优化并开发了高度敏感(>75%)和特异性(>90%)的血液和脑脊液基础检测,以检测在不同胶质瘤亚型中普遍存在的关键DNA(TERT C228T/C250T)和RNA(EGFRvIII)改变。在扩展对IDH1.R132H检测的工作中,研究团队之前利用BEAMing技术(包括小珠、乳浊液、扩增、磁性四个组分)的PCR技术可靠地检测胶质瘤患者脑脊液中的IDH1.R132H突变EV RNA转录本。在这项研究里,研究团队展示了一种名为mt-IDH1dx的液滴数字PCR(ddPCR)检测,用于在患者血浆衍生的EV RNA中稳健检测IDH1.R132H。为了评估研究人群(N=133)中的检测性能,研究团队在三个独立队列中进行双盲验证测试。来自IDH1.R132H患者(n=80)、IDH1野生型胶质瘤(n=44)和年龄匹配的健康对照(n=9)的基线血浆测试结果显示,与组织金标准相比,整体敏感性为75.0%(95% CI:64.1%-84.0%),特异性为88.7%(95% CI:77.0%-95.7%),阳性预测值为90.9%,阴性预测值为70.1%,表现出临床相关的诊断敏感性和特异性。除了基本的诊断应用外,研究团队展示了所提出的基于血液的mt-IDH1dx平台检测在8例IDH1.R132H改变患者的纵向疾病监测和随访中的实用性。最后,优化的工作流程使得在采样后4小时内快速高效地完成肿瘤组织和血浆检测成为可能。参考文献:Clinical utility of a blood based assay for the detection of IDH1.R132H-mutant gliomas. Nat Commun. 2024 Aug 16;15(1):7074.




