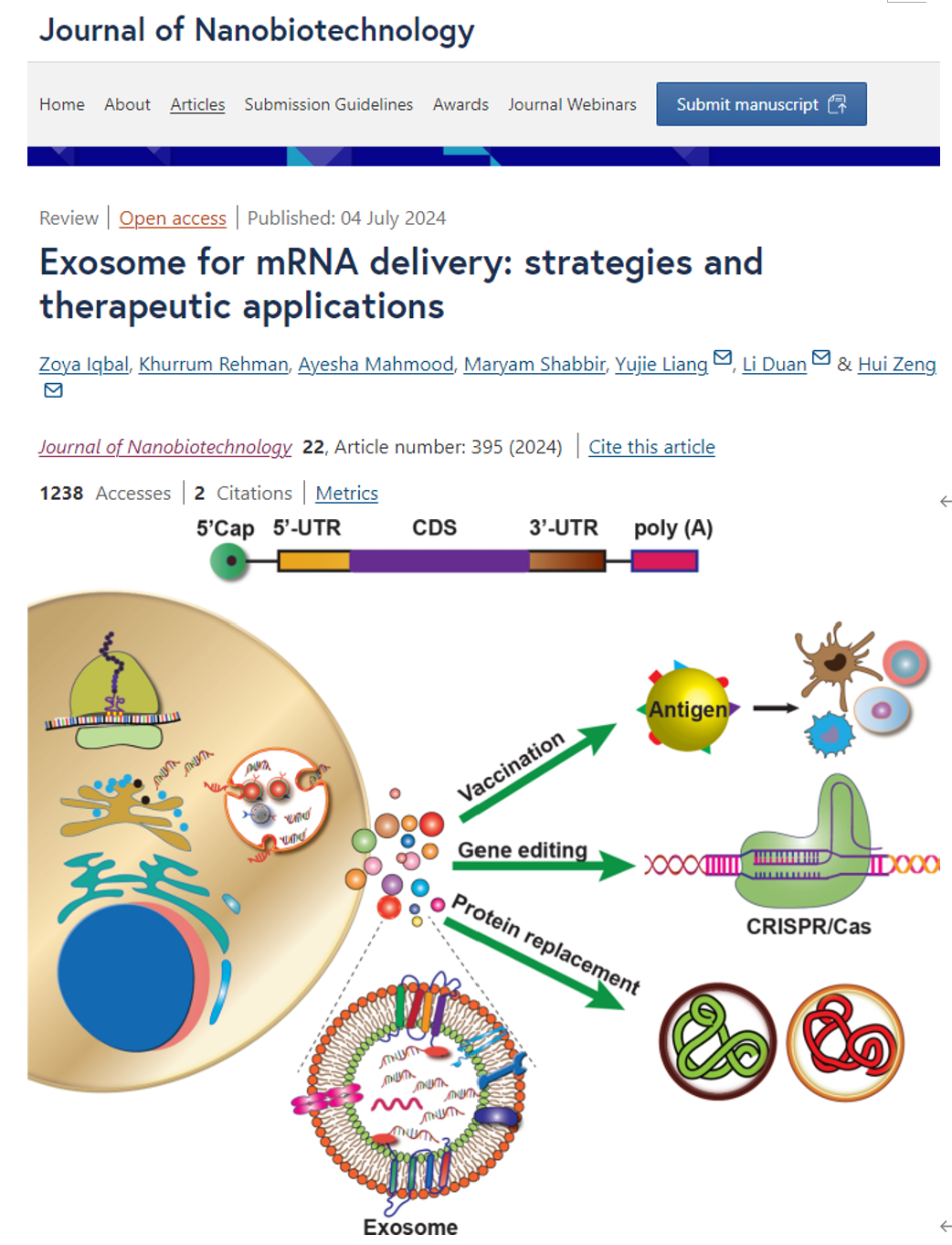
随着两种 COVID-19 mRNA疫苗的问世,基于 mRNA 的治疗取得了重大进展。然而由于 mRNA 自身稳定性和递送效率的限制,而且具有很高的免疫原性。 因此,开发高效靶向递送系统和稳定进行mRNA递送的平台是mRNA 发挥预防和治疗各种疾病方面关键技术。
虽然脂质纳米颗粒(LNPs)是mRNA 疫苗首选载体,已得到应用广泛,开发程度高,技术也相对成熟,但LNP仍然存在局限性,阻碍其实际应用。另一方面,有证据表明,外泌体似乎是 LNPs 的有力竞争者。由于外泌体具有良好的生物相容性、低免疫原性和穿越生物屏障(如 BBB)的能力,因此作为 mRNA 运送载体具有很多优势。
近日, 深圳市第二人民医院骨科研究团队针对细胞外囊泡递送mRNA关键技术,在国际纳米生物学权威期刊Journal Of Nanobiotechnology上发表了题为 “Exosome for mRNA delivery: strategies and therapeutic applications”的论文(2024 Aug 27;22(1):514.),深度阐明外泌体递送mRNA的巨大治疗潜力,特别是在基因治疗和免疫治疗等领域异军突起。
天然囊泡已被应用于mRNA的传递,它们为提高mRNA治疗从肿瘤到COVID-19等多种疾病的疗效提供了一个很有希望的机会。然而,在转化应用之前,还有一些问题尚未得到解决。包括固有异质性囊泡的关键参数的标准化,如表面特征和自体内容物。此外,在目标器官中的生物分布也值得进一步改进。未来,合理设计工程化的EVs将为开发更有效和更有选择性的细胞源囊泡提供巨大价值,从而加速它们的临床转化。
文章第一作者为骨科基础研究团队外籍博士后Zoya Iqbal,深圳市第二人民医院曾辉教授、段莉研究员及深圳市康宁医院梁宇杰研究员。该项工作得到国家科技部、国家自然科学基金及广东省高水平医院建设专项资金特别支持。
参考文献:
Yin-Yang: two sides of extracellular vesicles in inflammatory diseases. J Nanobiotechnol 22, 514 (2024). https://doi.org/10.1186/s12951-024-02779-9.
外泌体资讯网 Journal of Nanobiotechnology|深圳市第二人民医院骨科团队:外泌体递送mRNA的包封方法与靶向策略