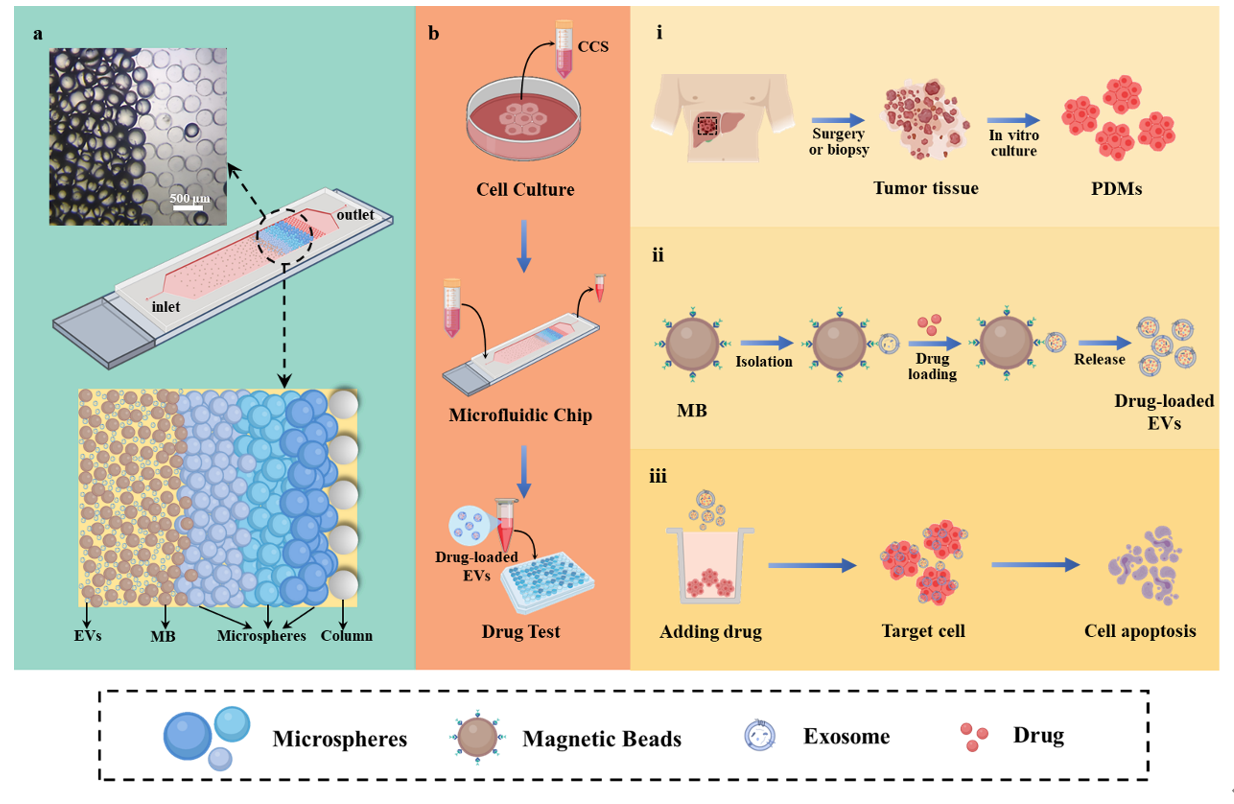
细胞外囊泡(EVs)在药物递送和抗肿瘤治疗中显示出巨大的潜力。然而,受限于较差的靶向能力和缺乏有效的分离技术,基于EVs的给药方案在临床应用中仍面临巨大障碍。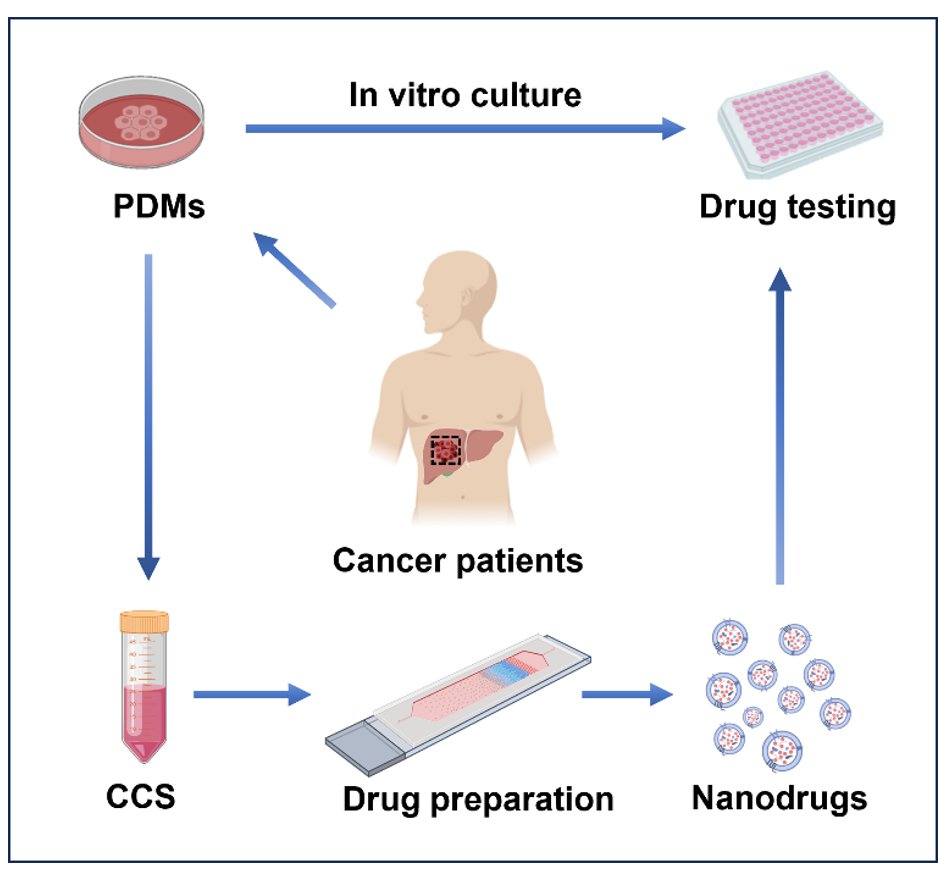
针对上述问题,西湖大学贾长库/浙大姚波/福建医科大叶凯团队开发了一种基于微流控芯片的患者肿瘤类器官来源的个性化纳米药物(PT-EVs)递送平台。在该药物递送方案中,集成EVs捕获、富集、载药和洗脱等功能于一身的微流控芯片可以高效制备载药EVs,回收率达65%,明显优于传统的超速离心法(UC)。同时,创新性的选用肿瘤类器官作为EVs来源也是该工作的一大亮点。一方面,利用肿瘤来源EVs的归巢作用可以实现药物对同源肿瘤的精准递送,从而显著提高化疗药物的疗效。此外,随着体外类器官的培养,可以源源不断的生产用于肿瘤治疗的EVs,一定程度上解决了传统原代 EVs 产量有限的问题。上述结果表明,该药物递送平台有望成为一种有效的个性化药物定制工具。相关工作以“Microchip Based Isolation and Drug Delivery of Patient-Derived Extracellular Vesicles Against Their Homologous Tumor”为题发表在Advanced Healthcare Materials上(doi.org/10.1002/adhm.202401990)。该工作的方案如下图所示。首先,通过手术或活检获得原发肿瘤组织,并将其转移到低吸附培养皿中进行体外培养3-7天,从而获得与原发肿瘤高度相似的体外类器官(i)。在培养过程中,不断收集细胞培养上清(CCS)并将其浓缩后注入到微流控芯片中以制备载药PT-EVs(ii)。最后,从芯片中洗脱的纳米药物被添加到相应的类器官中进行个体化药敏试验(iii)。载药的PT-EVs通过肿瘤归巢效应对其亲本细胞表现出特异性靶向,随后被肿瘤细胞内化。这一过程导致药物在肿瘤细胞内大量积累,最终诱导细胞凋亡。总之,为了解决载药EVs临床应用之前的一些局限性,这项工作开发了一种新颖的基于肿瘤类器官来源EVs的个性化纳米药物递送平台。该平台利用微流控芯片将药物包载入肿瘤患者体外类器官模型来源的EVs中,并通过归巢效应递送至原发肿瘤灶以实现自我治疗。相比于传统的给药方案,该纳米药物在肿瘤细胞系和患者来源的原代肿瘤类器官模型中都显示出更好的肿瘤靶向性和细胞毒性。因此,该平台作为一种新型的药物递送方案具有很高的性能和可行性,在精准医疗领域具有很大的潜力。K. Ge, Y. Ren, Z. Hong, Z. Mao, B. Yao, K. Ye, C. Jia, Microchip Based Isolation and Drug Delivery of Patient-Derived Extracellular Vesicles Against Their Homologous Tumor. Adv. Healthcare Mater. 2024, 2401990. https://doi.org/10.1002/adhm.202401990外泌体资讯网 ADV HEALTHC MATER:微流控芯片制备的肿瘤类器官来源载药细胞外囊泡用于同源肿瘤的精准治疗