围产医学的进步提高了超早产儿(出生孕周小于28周)的存活率,但同时也增加了患支气管肺发育不良(BPD)的风险。BPD是一种慢性肺部疾病,其特征是血管化受损、肺泡化停滞和肺功能降低。研究显示,高氧环境下内皮祖细胞(EPC)的丧失对BPD的发生有重要影响,然而其具体机制仍不清楚。巨噬细胞的细胞外囊泡(EV),可通过囊泡内的脂质、mRNAs、miRNAs和生物活性蛋白等调节受体细胞,在细胞间通信中发挥关键作用。已有研究表明巨噬细胞来源的EV参与了各种肺部疾病的发生,那么其是否也参与了BPD的发生?是否与BPD患儿的EPC丢失有关?
近日,南方医科大学附属深圳市妇幼保健院新生儿科林冰纯主任医师、陈雪雨副研究员团队在Stem Cell Research & Therapy杂志上发表题为“Macrophage extracellular vesicle-packaged miR-23a-3p impairs maintenance and angiogenic capacity of human endothelial progenitor cells in neonatal hyperoxia-induced lung injury”的论文(2024 Sep 11;15(1):295),主要介绍了巨噬细胞的细胞外囊泡通过miR-23a-3p耗竭内皮祖细胞的干性和功能,并参与BPD的发生。 第一作者为王宣,通讯作者为林冰纯、陈雪雨,课题组带头人杨传忠。
作者首选在小鼠BPD模型中证实肺组织中巨噬细胞的增加及EPC的丢失,且通过相关性分析发现BPD肺组织中巨噬细胞的数量与EPC数量呈显著负相关,提示高氧暴露下新生小鼠肺中的巨噬细胞浸润与c-Kit+内皮祖细胞(EPCs)的丢失有关。作者接下来采用氯磷酸盐脂质体(CLO-lipo)耗竭巨噬细胞后,发现可以减少高氧暴露新生小鼠肺组织中EPCs的丢失,并在一定程度上改善由高氧引起的肺泡简化。这表明巨噬细胞的浸润可能至少部分导致了高氧环境下EPCs的丢失,进而影响新生小鼠肺发育。
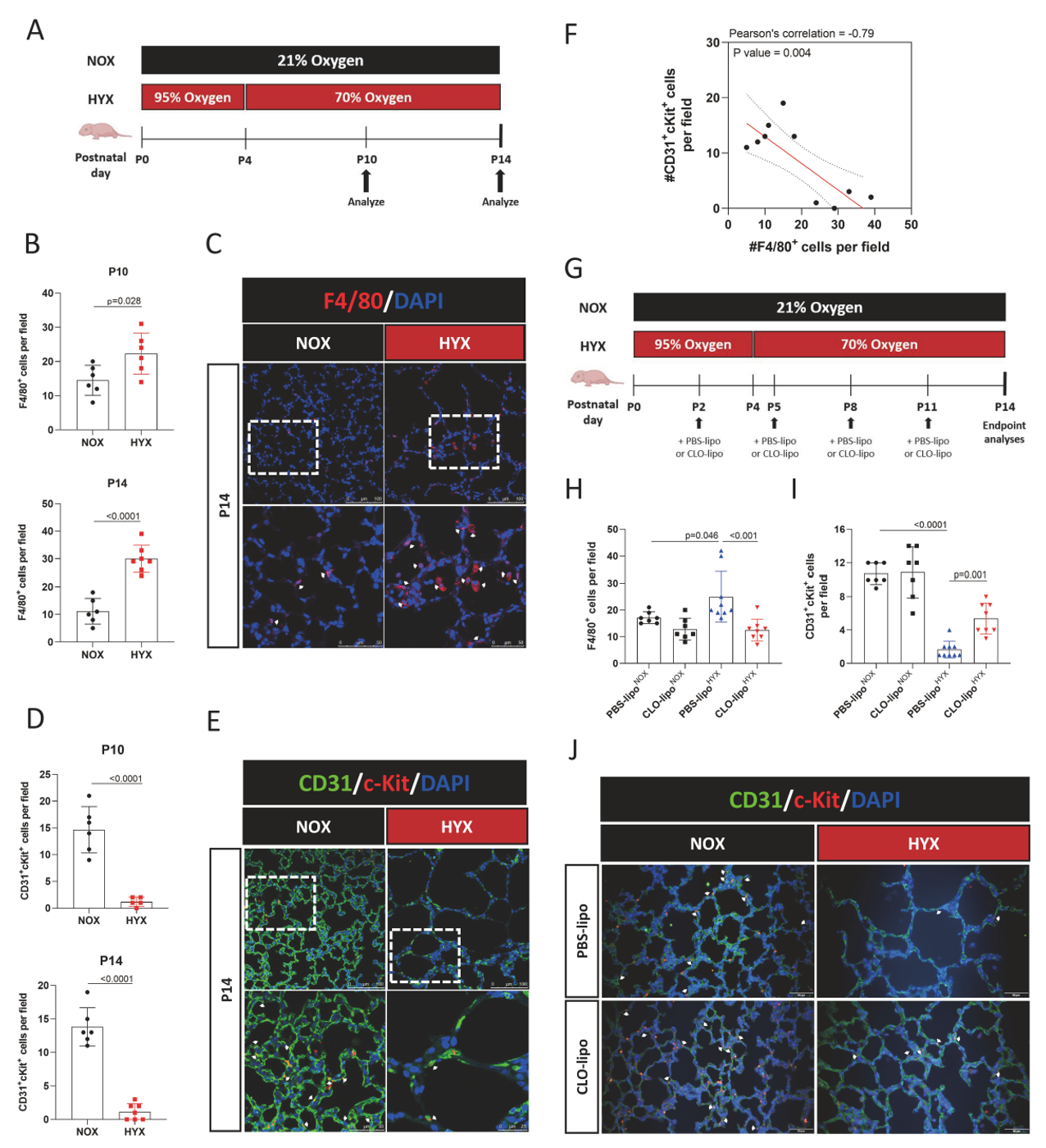
为了验证巨噬细胞与EPC的关系,作者收集了插管的早产儿气管抽吸物中分离出原代巨噬细胞(TA-M),以及团队前期自主构建的高氧诱导脐血单核细胞分化的巨噬细胞(HYX MDMs)的培养基(conditioned media, CM),去刺激脐血分离CD34+的EPC,发现TA-M及HYX MDMs的CM均可显著降低CD34+EPC的比例,并抑制其增殖,促进其凋亡。该实验还表明,高氧诱导脐血单核细胞分化的巨噬细胞(HYX MDMs)可以很好得模拟从BPD气道中分离出的原代巨噬细胞,这弥补了由LPS诱导的巨噬细胞系RAW24.7和THP1在BPD研究中的不足。
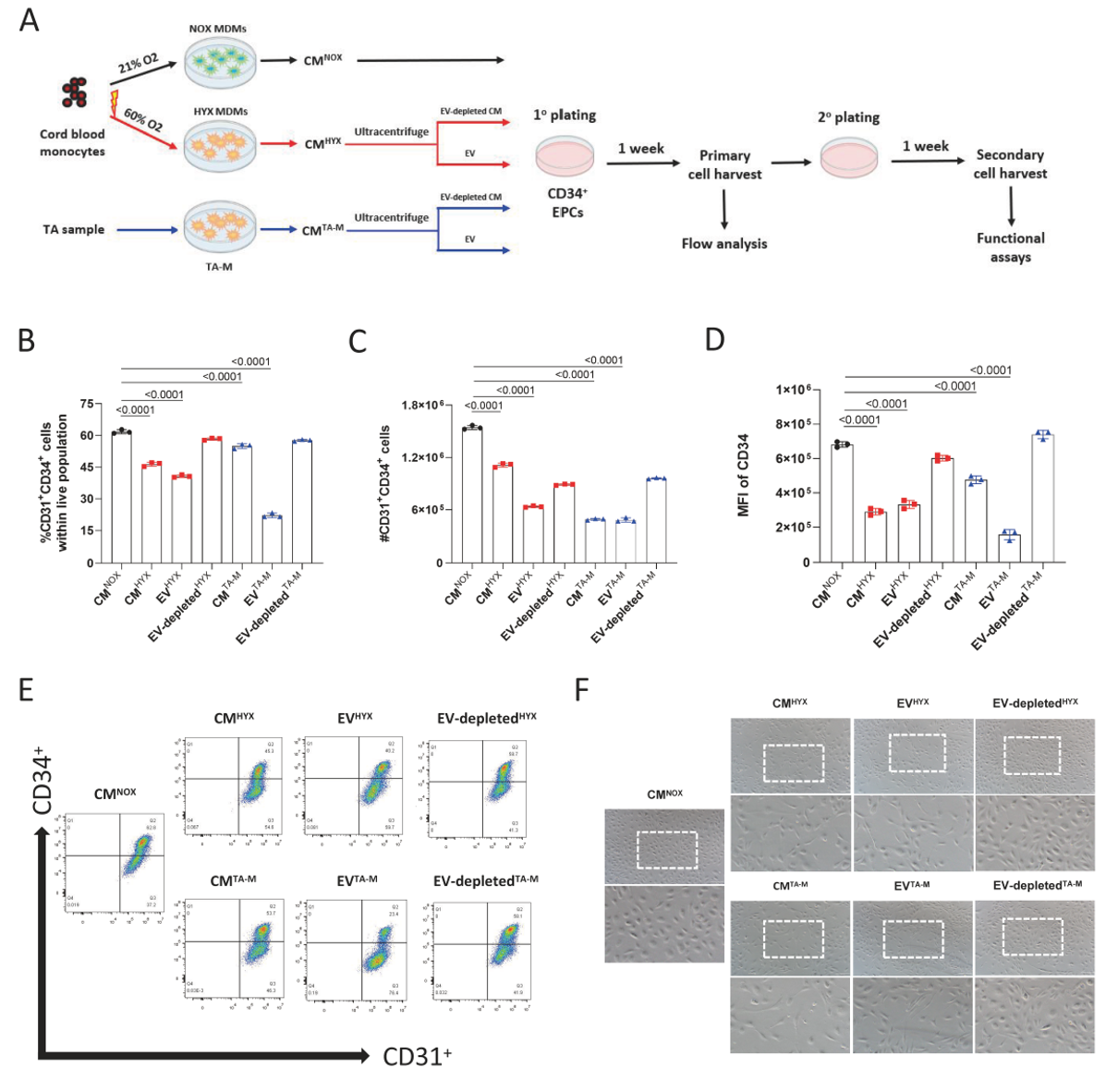
作者接下来对TA-M及HYX MDMs的CM进行了组分分离,并分别与EPC进行共培养,发现来自HYX MDMs(EVHYX)或TA-M(EVTA-M)分泌的EVs显著降低了CD34+ EPCs的百分比和数量,并下调了CD34表达(图3B-E)。这些效应归因于EVs,因为来自HYX MDMs或TA-M的EV去除CM没有显示出对CD34+ EPCs的类似抑制作用。此外,EV去除CM处理的EPC大多数细胞呈现出圆形,与未分化的EPC形态类似,而EV处理的EPC则呈现出典型的纺锤体样分化形态,这进一步支持了高氧巨噬细胞通过EV促进CD34+ EPCs的分化。
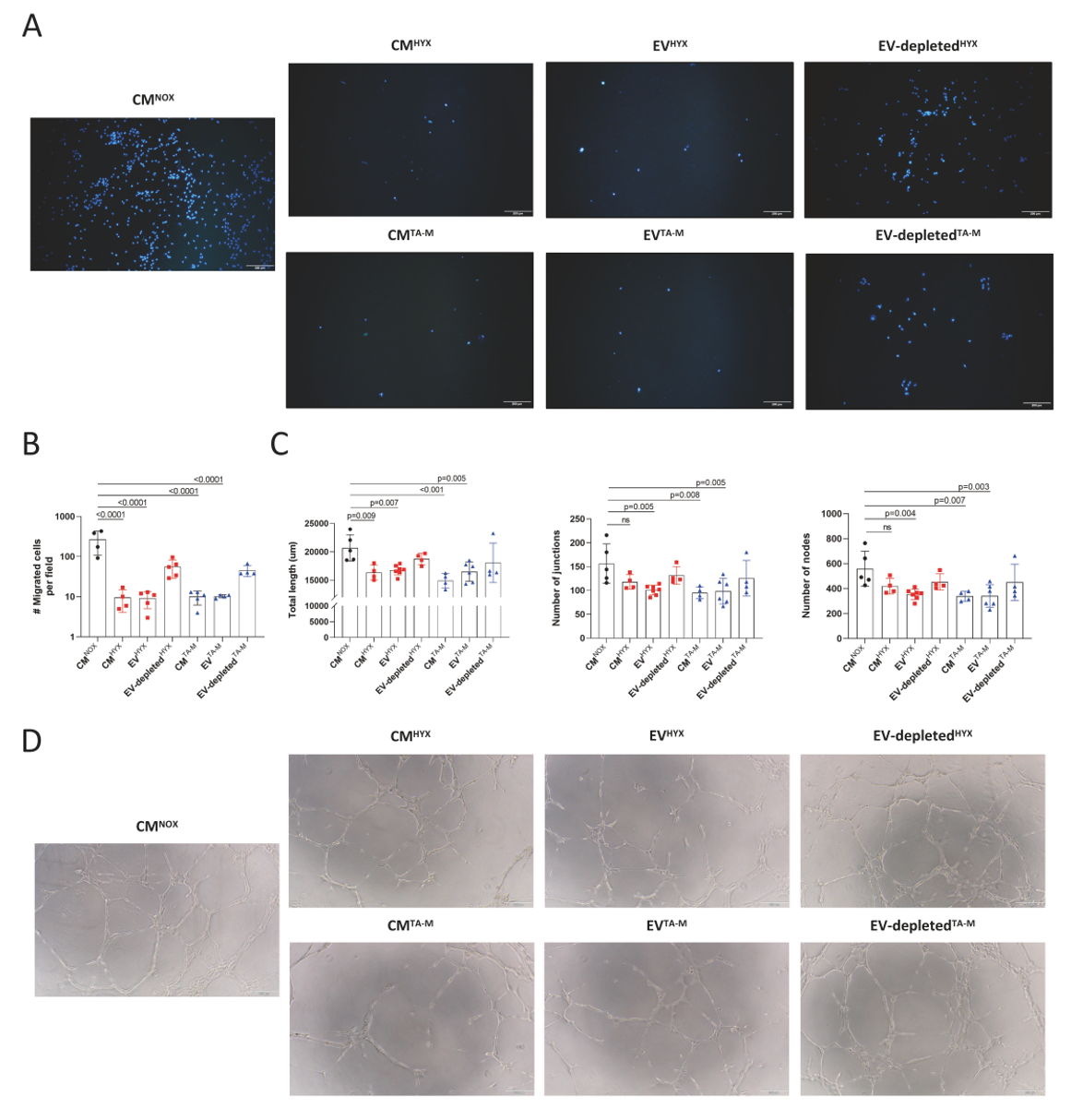
为了评估CD34+ EPCs摄取EVs后的其后代细胞功能的变化,作者接下来从初始培养物中重新培养细胞,并在次级收获时对分化的后代进行内皮功能测定(图3A)。来自EVHYX处理和EVTA-M处理组的分化后代在迁移能力(图4A-B)和血管网络形成(图4C-D)方面都表现出明显的减少,从而重现了各自的CM对内皮功能的抑制效应。这些数据表明,高氧巨噬细胞通过EV传递抑制CD34+ EPCs的维持并损伤其后代内皮细胞的功能。
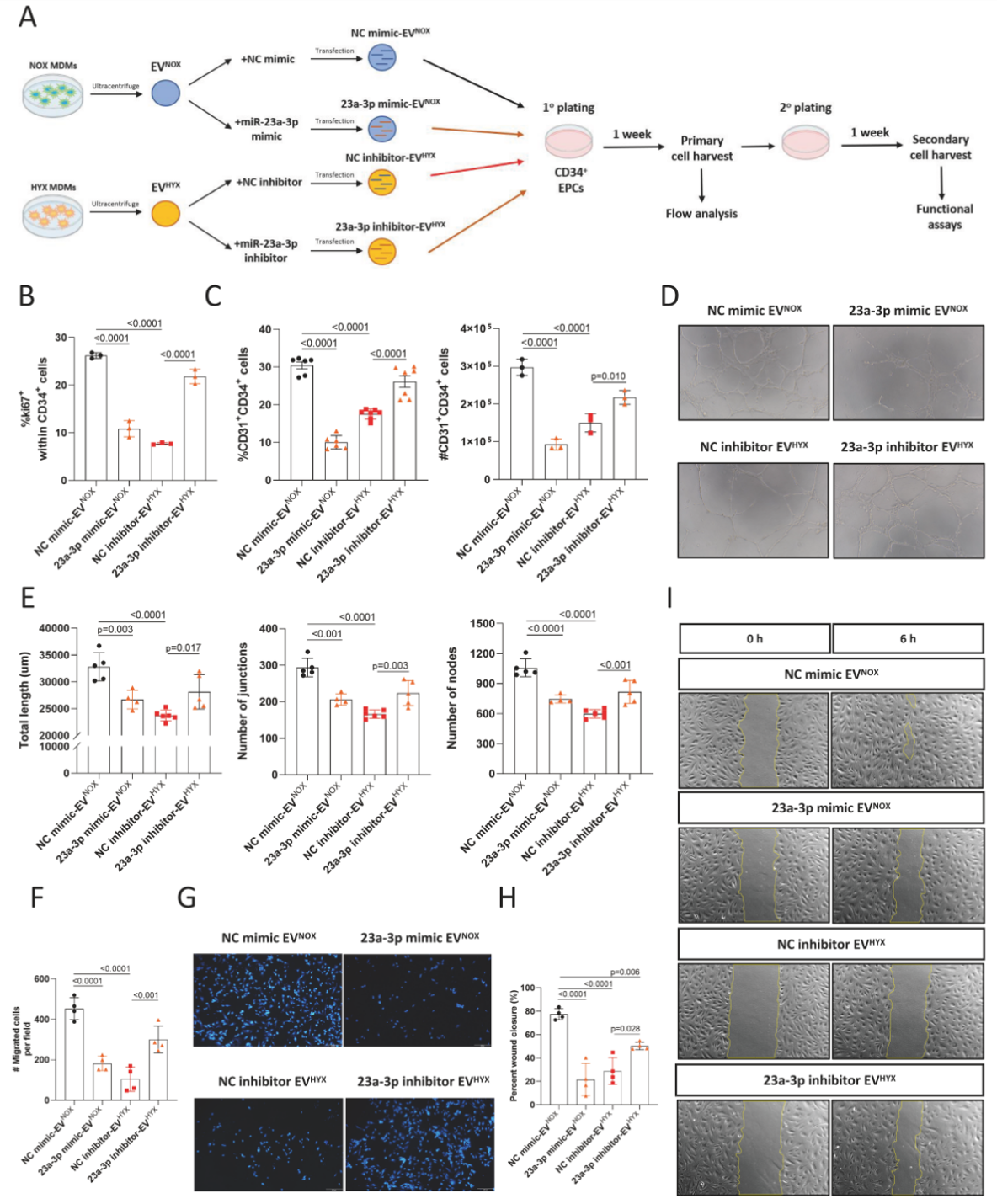
作者接下来对常氧处理的MDM、高氧处理的MDM及TA-M分离的EV进行了miRNA测序,通过将常氧与高氧、常氧与TA两对联合分析锁定了3个候选miRNA: miR-191-5p, miR-532-5p及 miR-23a-3p。作者将上述三个候选miRNA的类似物序列分别转染至EPC中,最终通过锁定了miR-23a-3p是巨噬细胞EV损伤EPC的幕后黑手。
为了充分证实miR-23a-3p的作用,作者接下来将miR-23a-3p类似物及拮抗物序列分别转染至常氧及高氧培养的巨噬细胞分离的EV中,并将改造后的EV分别与EPC进行共培养,发现转染了miR-23a-3p类似物序列的常氧巨噬细胞EV可加快EPC中CD34+比例的丢失,并抑制EPC后代的迁移及小管形成功能,与前面观察到的高氧巨噬细胞EV作用类似;而转染了miR-23a-3p拮抗物序列的高氧巨噬细胞EV则能显著保存EPC中CD34+比例,并改善高氧巨噬细胞EV造成的EPC后代的迁移及小管形成能力损伤。
作者最后在动物实验中验证了他们的发现,通过给高氧暴露小鼠注射antagomiR-23a-3p,作者发现体内将miR-23a-3p拮抗后,小鼠肺组织中EPC比例及数量显著改善,肺血管密度显著提升,且肺泡发育改善。

该研究表明高氧条件下的巨噬细胞能够造成小鼠和人类内皮祖细胞的耗竭。研究首次发现,高氧巨噬细胞通过释放富含miR-23a-3p的EVs来抑制EPCs的维持,并损害其分化后代的内皮功能。此外,研究还发现,体内抑制miR-23a-3p的表达可以作为一种新的药物策略,有助于恢复EPCs的维持和毛细血管密度,改善高氧造成的BPD表型。
研究受到国家自然科学基金(杨传忠、陈雪雨)、深圳市“三名工程”(SZSM202211001)、深圳市妇幼保健院院内课题基金(王宣)及深圳市孕产疾病与母婴健康重点实验室(ZDSYS20230626091559006)的资助。
外泌体资讯网 Stem Cell Res Ther|:揭秘巨噬细胞外囊泡中的miR-23a-3p如何成为早产儿支气管肺发育不良的幕后黑手?





