关节软骨由于缺乏神经、血管和淋巴管等,因此其损伤后难以愈合。寻找治疗软骨损伤类疾病的方法一直是科研界的热点。临床上通过移植软骨细胞治疗软骨损伤的策略取得了很不错的效果,但是研究发现移植的细胞在体内会发生凋亡,释放凋亡囊泡,这些囊泡是否在软骨细胞移植过程中发挥后续的治疗作用依然是未知。
近日,解放军总医院骨科医学部郭全义教授、刘舒云副教授团队和中山大学第一附属医院郭维民团队在Chemical Engineering Journal上发表题为“Chondrocyte-derived apoptotic vesicles enhance stem cell biological function for the treatment of cartilage injury”的论文,该研究的主要亮点如下:1.通过组学和测序技术绘制软骨细胞来源的凋亡囊泡(Cho-apoVs)的蛋白图谱和核酸图谱,并分析了其可能在软骨修复中发挥的治疗作用;2.证实了Cho-apoVs能够在体外促进骨髓间充质干细胞(BMSCs)的增殖、迁移和软骨分化,其中促软骨分化作用归功于Cho-apoVs中的miR-16-5p能够调节TGF-β信号通路;3.构建了将Cho-apoVs和脱细胞软骨基质支架相结合的无细胞组织工程策略,该策略在体内达到了良好的软骨再生效果。华中科技大学博士研究生殷瀚、南开大学博士研究生田广招,中山大学附属口腔医院副教授郑金绚和硕士生唐艺琪成为共同第一作者。解放军总医院骨科医学部郭全义教授、刘舒云副教授和中山大学第一附属医院郭维民助理研究员为共同通讯作者。
图1 研究的流程图该工作证明了移植的软骨细胞在关节软骨损伤处发生了凋亡,并证明Cho-apoVs能够促进干细胞的增殖和迁移,并且递送miR-16-5p激活TGF-β信号通路以促进干细胞成软骨分化。最后在体内通过脱细胞软骨基质支架联合Cho-apoVs关节腔注射实现关节软骨的功能性再生修复。该研究揭示了移植的软骨细胞促进软骨再生的新机制,初步理解了移植的软骨细胞存活率低与这些细胞产生的有益治疗效果之间的悖论,并为利用Cho-apoVs的基于无细胞组织工程的软骨再生提供了新的实验基础。

图2 移植的软骨细胞在体内的数量变化及凋亡情况(a) Dio标记的软骨细胞(绿色荧光)在体内第12h的数量。(b) Dio标记的软骨细胞在体内第24h的数量。(c) Dio标记的软骨细胞在体内第48h的数量。(d) 数据a,b,c的绿色荧光强度定量结果。(e) Dio标记的软骨细胞在体内第12h的TUNEL染色结果(红色:TUNEL染色阳性的细胞,蓝色:Dio标记的软骨细胞)。为了探究关节腔内移植的软骨细胞命运,首先通过激光共聚焦检测Dio荧光标记软骨细胞,证明了移植的软骨细胞在关节内早期即发生了凋亡,为后续进一步研究提供了实验基础。
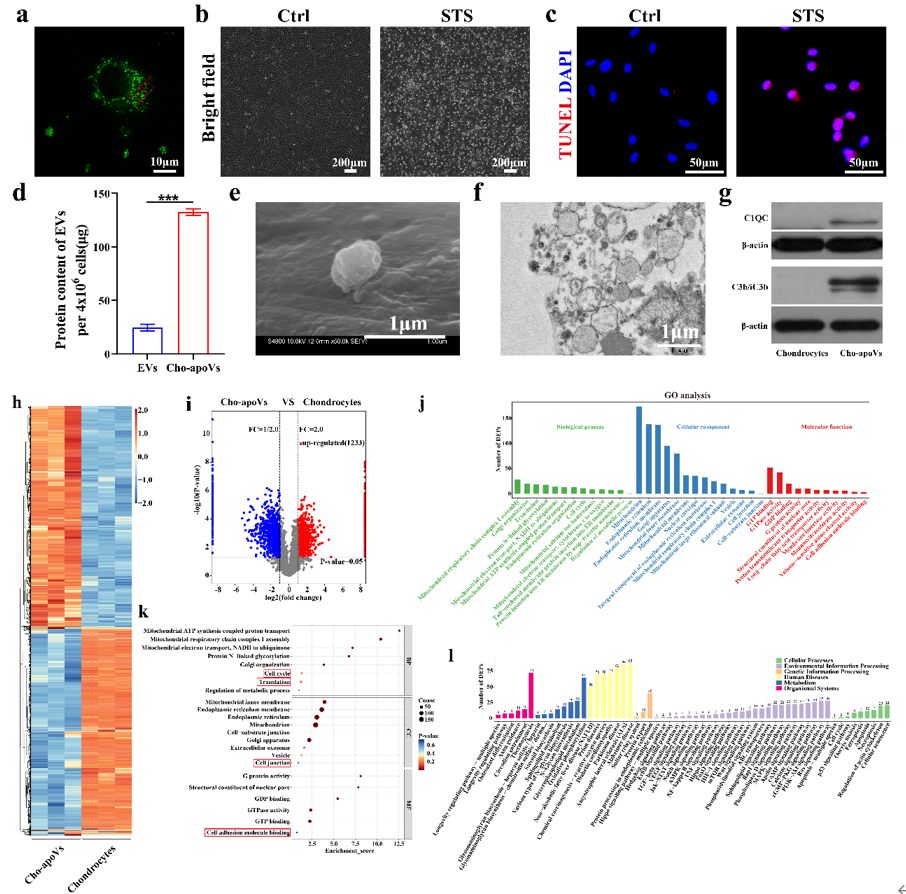
图3. Cho-apoVs的表征和蛋白组学分析(a) STS处理24h的Dio膜染料标记的软骨细胞凋亡荧光共聚焦图片(红色箭头指示出细胞膜表明形成的apoVs)。(b) STS处理前后的软骨细胞的形态变化。(c) STS处理前后的软骨细胞的TUNEL荧光染色结果(红色代表凋亡细胞)。(d) STS处理的软骨细胞分泌的apoVs和未使用STS处理的软骨细胞分泌的EVs的相对蛋白质含量比较。(e) SEM下的Cho-apoVs的形态。(f) TEM下的Cho-apoVs的形态。(g) WB检测Cho-apoVs中C1QC和C3b/iC3b蛋白的表达。(h) 对软骨细胞和Cho-apoVs之间的差异表达蛋白进行层次聚类分析,并对蛋白丰度进行Z评分标准化(行表示蛋白质,列表示单个样本重复)。(i) Cho-apoVs与软骨细胞相比显著上调(红点)和下调(蓝点)的蛋白的火山图显示结果。(j) GO富集分析Cho-apoVs中上调的蛋白,将其分为“细胞组分”、“分子功能”和“生物学过程”。(k) Cho-apoVs中上调的蛋白的GO富集分析结果。(l) Cho-apoVs上调的蛋白的KEGG通路分析结果。为了进一步表征Cho-apoVs及潜在机制研究,首先对其所含的蛋白质进行解析,结果显示Cho-apoVs含大量参与软骨再生过程的功能性蛋白。
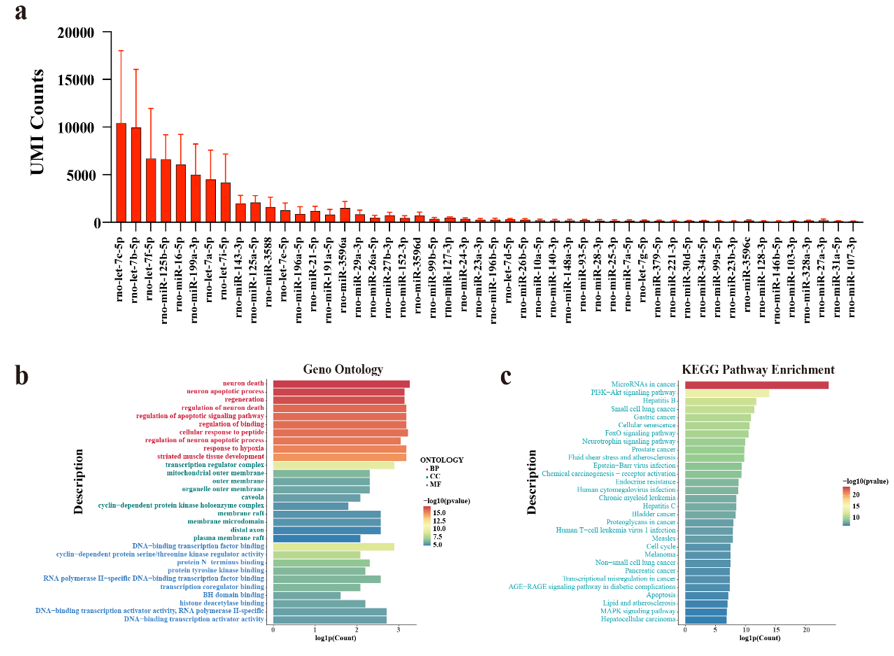
图4. Cho-apoVs中的small RNAs检测结果和生物信息学分析(a) Cho-apoVs中的top 50 miRNAs。(b) Cho-apoVs中的TOP 50 miRNAs GO富集分析结果。(c) Cho-apoVs中的TOP 50 miRNAs KEGG通路富集分析结果。为了进一步解析Cho-apoVs的生物学组成,对其又进行了miRNA测序,结果显示Cho-apoVs含调控软骨再生和发挥促软骨修复的miRNA。
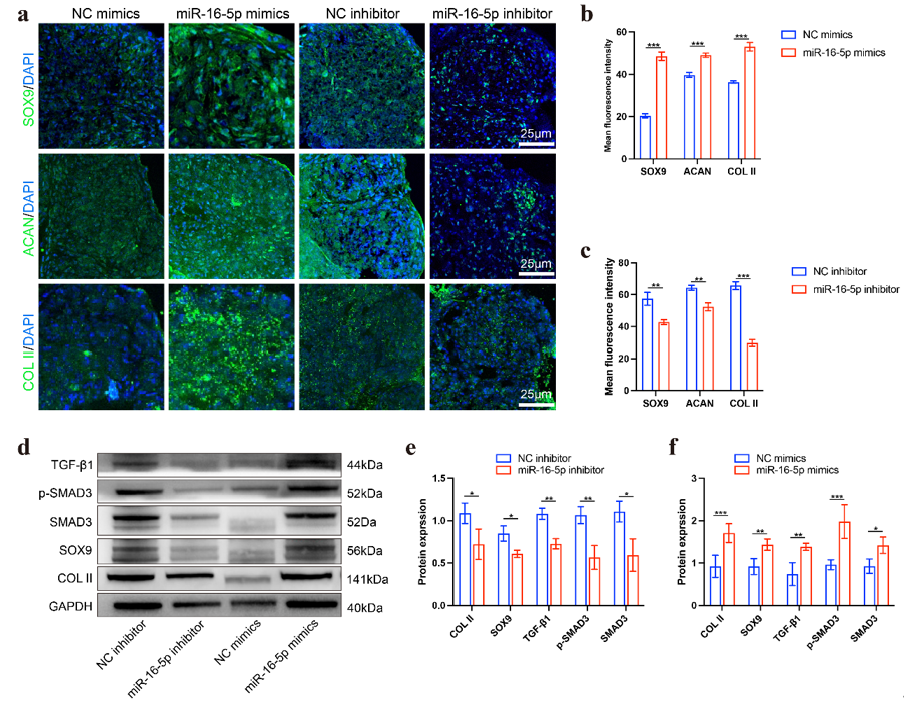
图5. miR-16-5p通过激活TGF-β通路促进BMSCs软骨生成(a) miR-16-5p提高软骨形成相关基因(SOX9,ACAN,COL II)表达的IF染色结果图。(b) miR-16-5p模拟物促进软骨生成相关基因表达的荧光强度统计学分析结果。(c) miR-16-5p抑制剂抑制软骨生成相关基因表达的荧光强度统计学分析结果。(d) GAPDH、COL II、SOX9、SMAD3、p-SMAD3和TGF-β1表达的WB分析。(e-f) 数据d的定量分析。进一步体外证明了Cho-apoVs内miR-16-5p激活TGF-β信号通路来促进BMSCs 的成软骨分化。
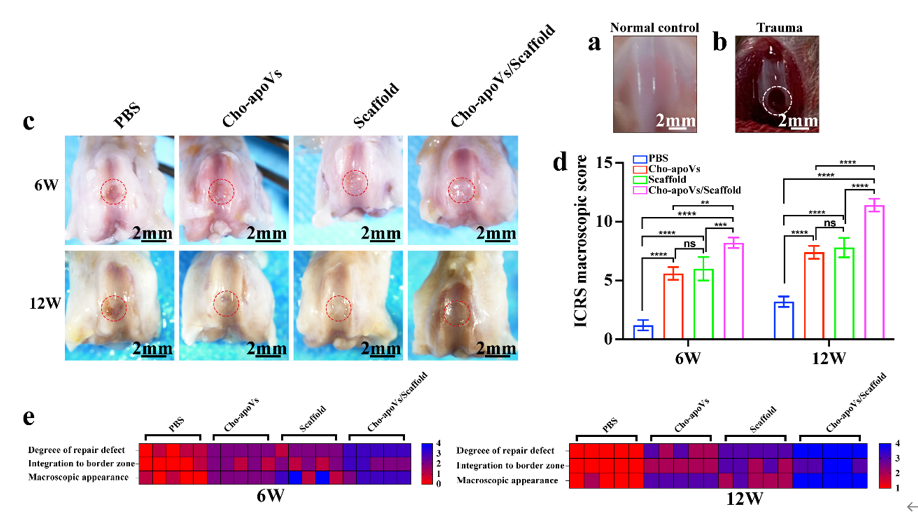
图6. 修复后大鼠膝关节的宏观评估
(a) 钻孔之前的关节软骨。(b) 钻孔之后的关节软骨。(c) 术后6周和12周修复组织的大体观。红色的圆圈表示缺陷区域。(d) 宏观评价的ICRS评分。(e) 术后6周和12周修复组织的ICRS评分变量的热图。
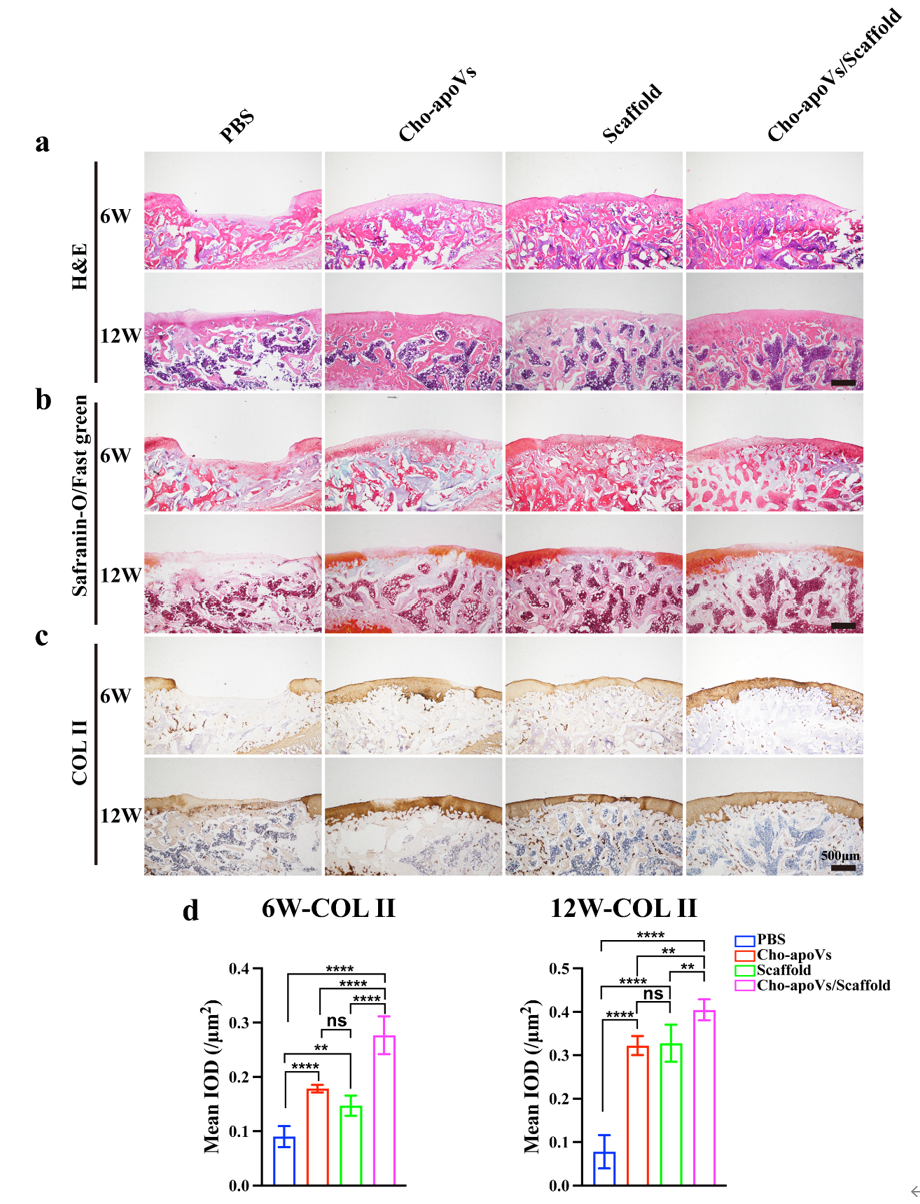
图7. 术后6周和12周修复组织病理学染色和评分
(a) 缺损区域的HE组织学染色。(b) 缺损区域的番红O固绿组织学染色。(c) 缺损区域的COL II免疫组化组织学染色。(d) COL II的定量统计学分析。
为了维持机体正常的生理稳态,人体内每天都有数十亿的细胞会发生调亡。在再生领域,细胞疗法是十分有效的策略,但是,尚未完全理解其治疗机制。有趣的是,证据表明,在细胞治疗过程中,大多数植入细胞在移植后经历凋亡。这一种移植细胞存活率低与这些细胞产生的有益治疗效果之间的相反的现象引起了研究界的广泛关注。近年来,研究人员发现,移植入体内的细胞会出现凋亡,并释放出一种叫做凋亡囊泡的物质,并且这些物质可以在组织内扩散并影响邻近细胞,因此就猜想凋亡囊泡可能在疾病中的发生发展中起到十分重要的作用。研究报道,凋亡囊泡能够起到清除凋亡细胞、抗原递呈和免疫反应的作用。作为基于活细胞治疗的替代方案,使用来自Cho-apoVs进行软骨损伤修复的可行性还没有被探索。在该研究中,研究人员构建了将Cho-apoVs和脱细胞软骨细胞外基质(DCECM)支架相结合的无细胞组织工程策略,评估了其软骨再生效果。在手术后6周和12周评估修复结果。如图6。术后6周时,对照组的缺损区域尚未被肉芽组织完全覆盖,而其他三组的缺损区已经被肉芽组织部分填充。Cho-apoVs组和DCECM支架组的填充面积大致相同(约50%),而Cho-apoVs/DCECM支架组的填充面积最大。手术后12周时,对照组、Cho-apoVs组和DCECM支架组的修复组织形状不规则,并且可以清楚地观察到修复组织和周围正常组织存在边界。对照组中的缺损区被肉芽组织部分填充(约25%)。Cho-apoVs组和DCECM支架组中填充面积达75%以上。Cho-apoVs/DCECM支架组的缺损区几乎被新生软骨组织完全替代,并且修复组织与正常组织融合良好,修复表面十分平整,接近正常组织。国际软骨修复协会 (ICRS) 评分进一步证实了这些发现。H&E、Safranin O/Fast Green 和 COL2 免疫组织化学染色(图7)显示在6周和12周时,Cho-apoVs组和Cho-apoVs /DCECM组中再生出的透明软骨数量多于对照组,并且Cho-apoVs/DCECM组显示出了最好的再生效果。上述实验表明DCECM和Cho-apoVs的组合有效促进了关节软骨的体内再生修复。并为支持Cho-apoVs作为软骨缺损修复的无细胞治疗方案提供了新的实验证据。总之,该研究开发了一种Cho-apoVs联合DCECM支架的无细胞治疗策略,该策略有望替代细胞疗法成为用于软骨损伤治疗的新疗法。参考文献:Han, Yin et al. “Chondrocyte-derived apoptotic vesicles enhance stem cell biological function for the treatment of cartilage injury.” Chemical Engineering Journal, vol. 497, 2024, doi:10.1016/j.cej.2024.154501.
外泌体资讯网 Chem Eng J|解放军总医院郭全义/中山附一院郭维民:软骨细胞来源的凋亡囊泡通过增强干细胞的生物学功能治疗软骨损伤