关节软骨疾病的治疗是全球医学研究领域面临的一项重大挑战,且该类疾病因其复杂性和治疗难度已成为全球致残率最高的疾病类型之一。目前基于间充质干细胞治疗软骨损伤最具有应用前景的方式之一,但其单独应用治疗效果有限及潜在机制仍未完全阐明。近日,解放军总医院骨科医学部郭全义教授、刘舒云副教授团队和中山大学第一附属医院郭维民团队在Bioactive Materials上发表题为“Promotion of osteochondral repair through immune microenvironment regulation and activation of endogenous chondrogenesis via the release of apoptotic vesicles from donor MSCs”的论文(2024 Aug 6:41:455-470),该研究一方面揭示了间充质干细胞移植至软骨损伤后通过凋亡囊泡调节免疫及激活内源性软骨生成的修复机制,另一方面建立了apoVs协同脱细胞软骨基质支架促进关节软骨损伤修复的无细胞组织工程修复策略。南开大学博士研究生生田广招、华中科技大学博士研究生殷瀚,中山大学附属口腔医院副教授郑金绚和硕士生余镕丞为共同第一作者。解放军总医院骨科医学部郭全义教授、刘舒云副教授和中山大学第一附属医院郭维民为共同通讯作者。该研究不但为干细胞的再生修复理论提供了新思路,而且也为软骨损伤修复的无细胞再生策略提供了新选择。研究发现示意图
该工作证明了移植的人脐带间充质干细胞(HUMSCs)在关节软骨损伤处快速凋亡,并证明HUMSCs来源凋亡囊泡(apoVs)递送 miR-100-5p 激活 MAPK/ERK 信号通路以促进巨噬细胞抗炎M2 型极化,递送 let-7i-5p 通过靶向 eEF2K/p38 MAPK 轴促进骨髓间充质干细胞成软骨分化。最后在体内通过脱细胞软骨基质三维支架结合apoVs关节腔注射实现关节软骨的功能性再生修复。该研究揭示了移植 MSCs 促进软骨再生的新机制,并为利用 apoVs 的基于无细胞组织工程的软骨再生提供了新的实验基础。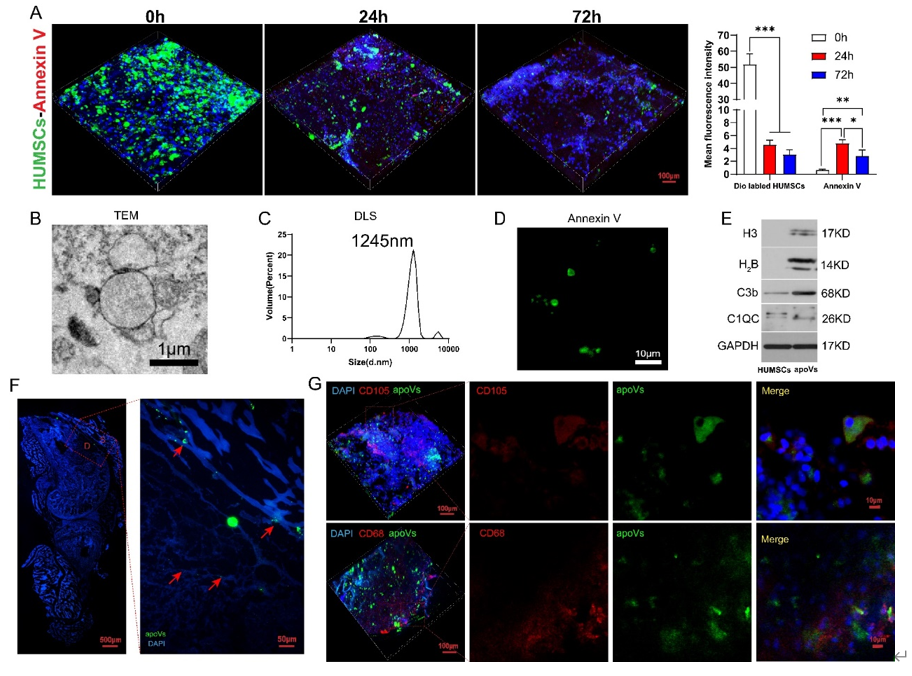
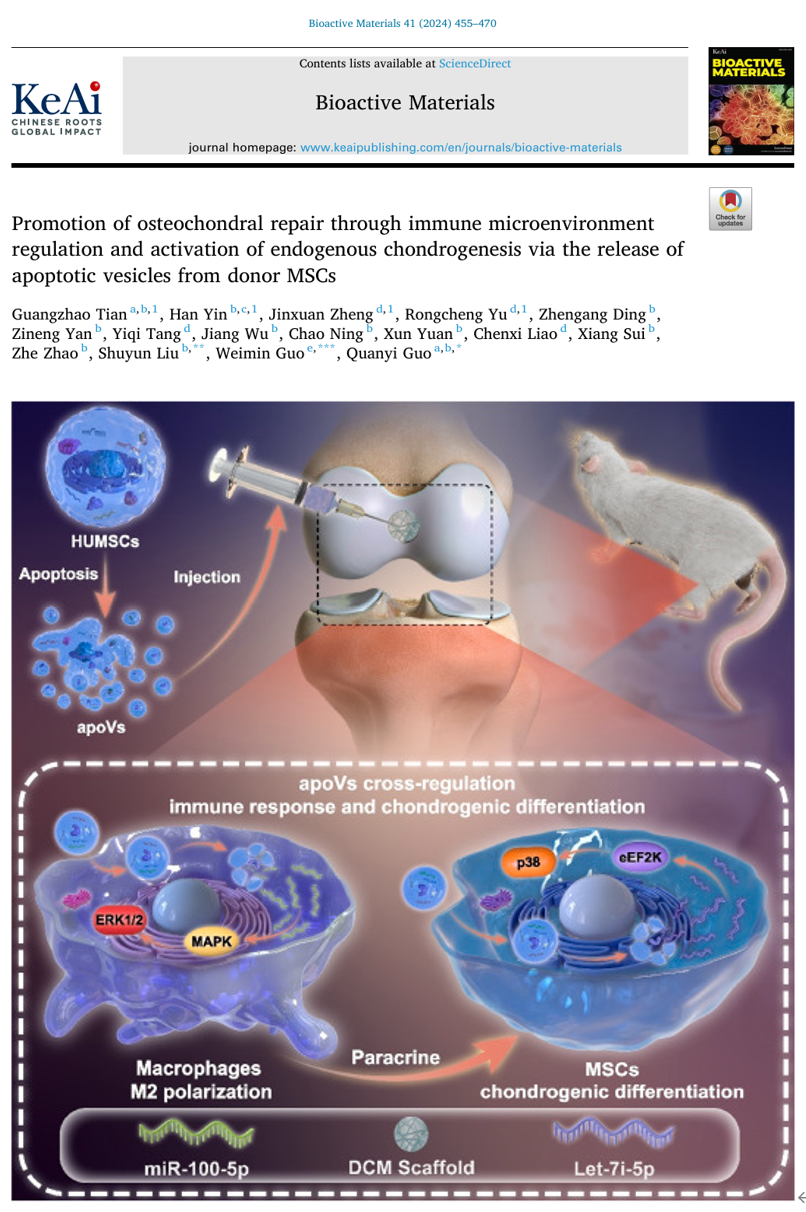
(A) 共聚焦显微镜图像显示植入后 0 小时、 24 小时和 72 小时DCM 支架内 HUMSCs 减少和凋亡细胞数量增加。(B) 显示 apoVs 形态的 TEM 图像。(C) apoVs的大小分布。(D) 共聚焦显微镜图像显示 apoVs 的 Annexin V 染色。(E) HUMSCs 和 apoVs 中 H3、H2B、C3b 和 C1QC 的蛋白质印迹分析。(F) 注射的 apoV 在软骨缺损和滑膜内的分布。(G) 软骨缺损内 MSC 和巨噬细胞对 dio 标记的apoV 的吞噬作用。为了探究关节腔内移植的干细胞命运,首先通过激光共聚焦检测荧光标记HUMSCs,证明了移植的HUMSCs在关节内早期即发生了大量凋亡,并通过体外提取并鉴定HUMSCs来源apoVs,证明了关节腔内注射的apoVs被间充质干细胞及巨噬细胞所吞噬。提示间充质干细胞可能通过凋亡囊泡调控巨噬细胞极化免疫调节及促进间充质干细胞成软骨分化实现软骨损伤修复再生作用。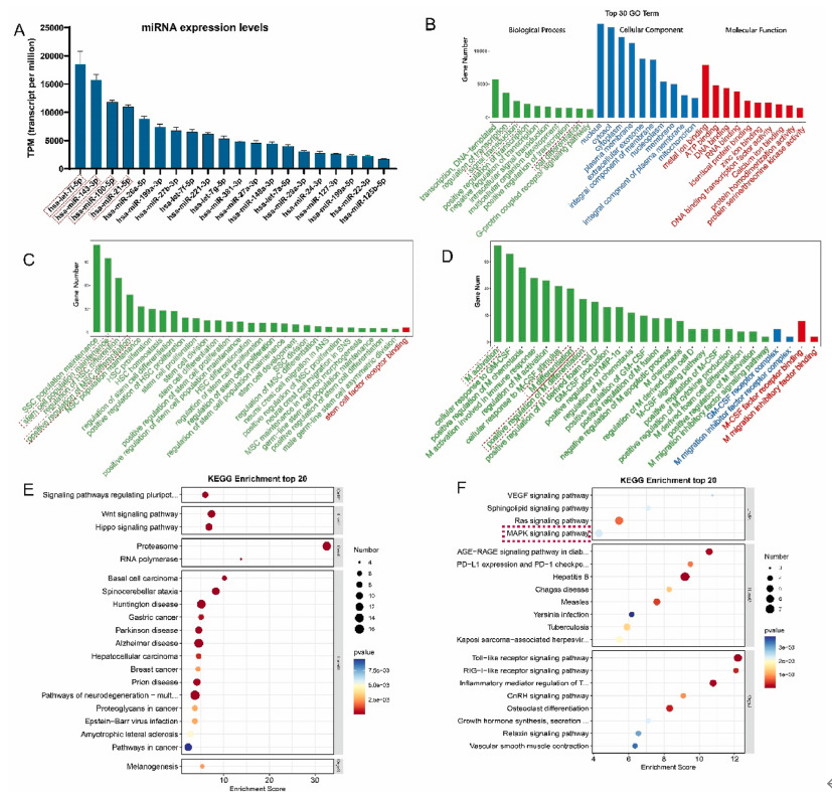
(A)apoVs 的前 20 个最丰富的miRNA。(B) 使用 TPM>2 对 miRNA 的靶基因进行 GO 分析。(C)与干细胞相关的靶基因的 GO 分析。(D)与巨噬细胞相关的靶基因的 GO 分析。(E)(C)中靶基因的 KEGG 通路分析。(F)(D)中靶基因的 KEGG 通路分析。
为了进一步表征apoVs及潜在机制研究,首先对其进行 miRNA 测序,结果显示apoVs含大量与巨噬细胞分化及间充质干细胞维持及分化的miRNA。
图 3. apoVs内mir-100-5p激活 MAPK/ERK 信号通路来促进巨噬细胞的 M2 极化(A)代表性免疫荧光图像,显示用不同 miRNA 模拟物或抑制剂转染的 BMDM 中巨噬细胞标志物的表达。(B) 转染不同 miRNA 模拟物或抑制剂的 BMDM 中 M2 标志基因(CD206和精氨酸酶-1)和 M1 标志基因(IL-6 和 iNOS)的相对 mRNA水平。(C、D)BMDM 中 MAPK 通路的蛋白质印迹分析。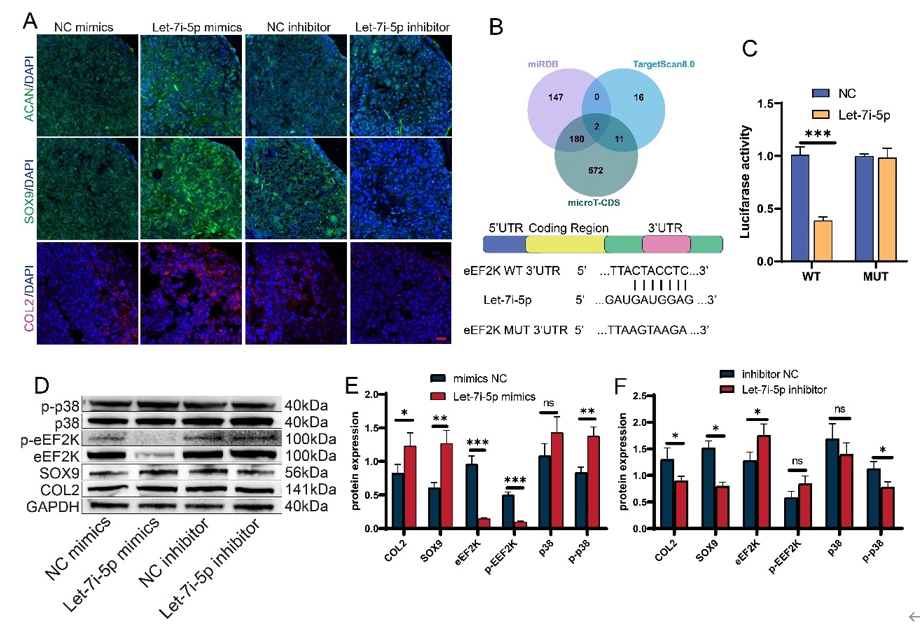
图4. Let-7i-5p 是 apoV 介导的 BMSC 软骨形成分化的效应子,靶向 eEF2K/p38 MAPK 轴(A) 转染 let-7i-5p 模拟物或抑制剂并用软骨形成分化培养基处理的 BMSC 沉淀物中 ACAN、SOX9 和 COL2 的免疫荧光。(B) 生物信息学分析用于预测 let-7i-5p 的潜在靶序列。(C) 转染 let-7i-5p 模拟物后 HEK293T 细胞中 3′-UTR-eEF2K-luc构建体的相对荧光素酶活性。(D-F)用软骨形成分化培养基处理并转染 let-7i-5p 模拟物或抑制剂的 BMSCs 的蛋白表达进一步体外证明了apoVs 内 miR-100-5p 激活 MAPK/ERK 信号通路来促进巨噬细胞的 M2 极化(图3),apoVs内let-7i-5p通过靶向 eEF2K/p38 MAPK 轴促进 BMSCs 的成软骨分化(图4)。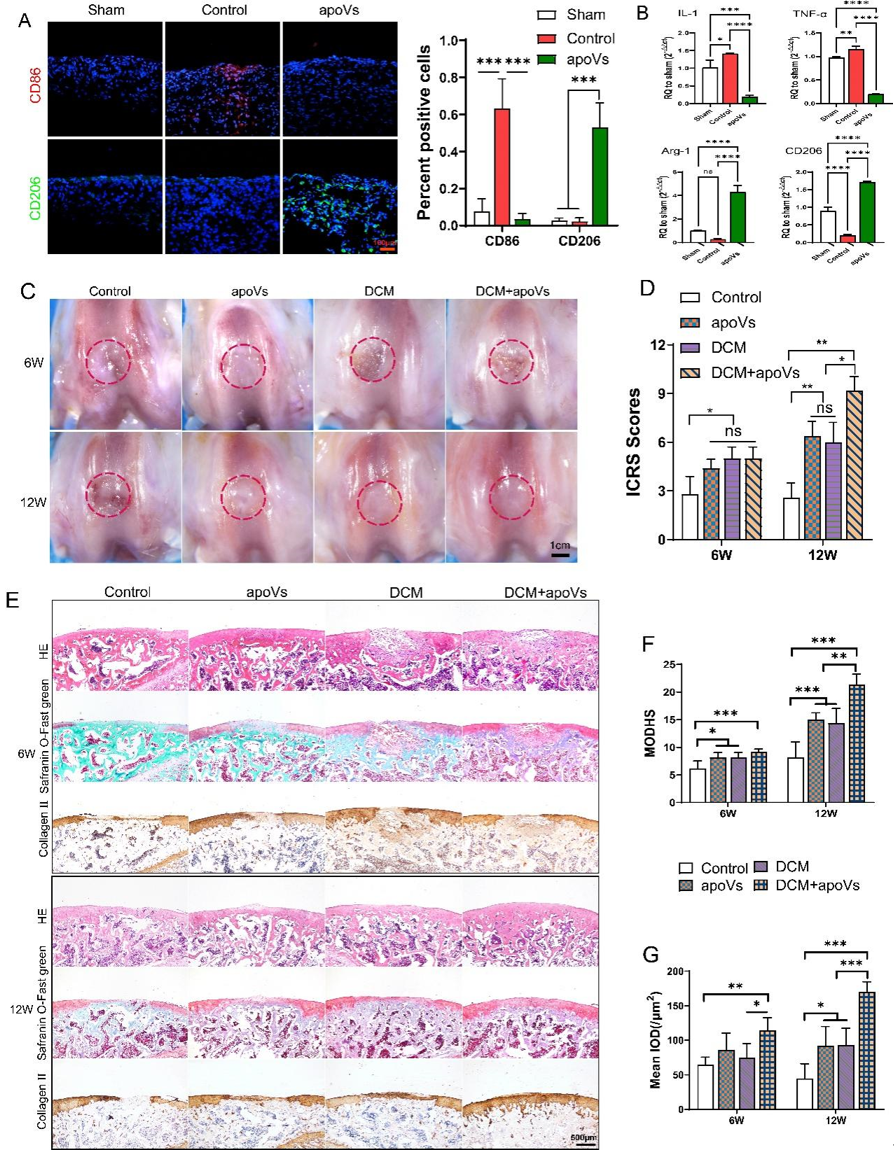
图5. 对关节微环境的调节作用和体内软骨再生的评价(A) 滑膜巨噬细胞 M1 和 M2 巨噬细胞标志物的免疫荧光分析以及 M1 和 M2 巨噬细胞的相对定量。(B) 滑膜中 IL-1、TNF-α、Arg-1 和 CD206 mRNA 表达水平的 qRT-PCR 分析。(C) 术后 6周和 12 周修复组织的代表性大体观。(D) 用于宏观评估的 ICRS 评分。(E) 第 6 周和第 12 周时骨软骨缺损的组织学 (HE,Safranin O-Fast Green) 和免疫组织化学分析。(F) 修复软骨的 MODHS 组织学评估。(G)COL2 免疫组织化学染色的定量分析。迄今为止,在探索旨在促进软骨修复的各种方法(例如生物材料、MSCs 及其衍生物)方面已经取得了广泛的进展。这些努力显示出通过再生策略解决这一医学难题的希望。团队先前的研究表明,脱细胞软骨细胞外基质(DCM)支架具有高度互连的多孔结构,可有效促进 MSCs 的增殖。此外,负载不同 MSCs 的 DCM 支架在绵羊、兔和大鼠软骨缺损模型中取得了令人满意的软骨修复效果。然而,临床条件下的细胞治疗存在各种局限性,包括免疫原性、不受控制的细胞分化和致瘤风险。因此,研究团队设计了一项概念验证研究,以评估 apoVs 与 DCM 支架联合使用的治疗效果。在手术后 6 周和 12 周评估修复结果。如图5。手术后6周,对照组显示白色纤维组织填充缺损部位,其特征是表面纹理粗糙,与周围软骨有明显的界限。apoVs组显示相对均匀的白色纤维组织填充。DCM 组和 DCM + apoVs 组显示部分再生透明软骨组织。植入后 12 周,DCM + apoVs 组软骨缺损修复明显,而对照组再生组织体积小于相邻健康软骨。apoVs 组和 DCM 组表现出与周围正常软骨高度相似的修复组织,表明再生成功。国际软骨修复协会 (ICRS) 评分进一步证实了这些发现。H&E、Safranin O/Fast Green 和 COL2 免疫组织化学染色 (图5E)显示在 6 周时均未观察到再生软骨组织。值得注意的是,软骨下骨显示出明显的间隙和空腔,植入的DCM 部分保留。然而,到 12 周时,DCM + apoVs组的缺损充满了均匀光滑的再生组织。再生区的 ECM 表现出透明的软骨特性,包括 COL2 和糖胺聚糖的产生。相比之下,apoVs 组和 DCM 组均显示部分再生软骨的厚度减少,而对照组没有表现出透明软骨的显着生成。这些发现强烈表明 DCM 和 apoVs 的组合有效促进了关节软骨的体内再生修复。并为支持 apoVs 作为软骨缺损修复治疗剂提供了新的研究证据。总之,该研究阐明了apoVs 在软骨损伤中发挥再生修复功能的新理论,为治疗关节软骨缺损提供了希望。此外,这些新再生策略的探索强调了使用 apoVs 作为 MSC 替代品进行软骨修复的无细胞应用潜力,有望加速软骨损伤修复的临床转化。Tian, Guangzhao et al. “Promotion of osteochondral repair through immune microenvironment regulation and activation of endogenous chondrogenesis via the release of apoptotic vesicles from donor MSCs.” Bioactive materials vol. 41 455-470. 6 Aug. 2024, doi:10.1016/j.bioactmat.2024.07.034外泌体资讯网 Bioactive Materials|解放军总医院郭全义/中山附一院郭维民:移植MSCs 释放凋亡囊泡促进骨软骨修复