细胞凋亡是细胞程序性死亡的最主要方式,其对机体维持组织稳态具有重要作用。在细胞凋亡过程中,细胞会产生了一种独特的细胞外囊泡群,称之为凋亡囊泡(Apoptotic extracellular vesicles, ApoVs)。ApoVs从其亲本细胞中继承多种生物分子,如蛋白质、RNA、核成分、脂质和气体递质。ApoVs已经在炎症、肿瘤、免疫紊乱和组织再生方面显示出有希望的治疗潜力。此外,ApoVs还可以用作药物载体、疫苗开发和疾病诊断。近年来,ApoVs已被用于临床试验治疗多种疾病,如颞下颌关节骨关节炎和功能性牙槽骨再生。近日,中山大学附属口腔医院施松涛教授课题组在Journal of Dental Research杂志上发表了“Apoptotic vesicles: therapeutic mechanisms and critical issues”的综述(2024 Sep 13:220345241265676),主要回顾了ApoVs分类、标记物;ApoVs研究的历史及其在口腔等疾病中的应用;目前ApoVs的临床前和临床研究,以及ApoVs应用的潜在问题。第一作者为欧乾民博士后、黄韦莹博士,通讯作者为施松涛教授。
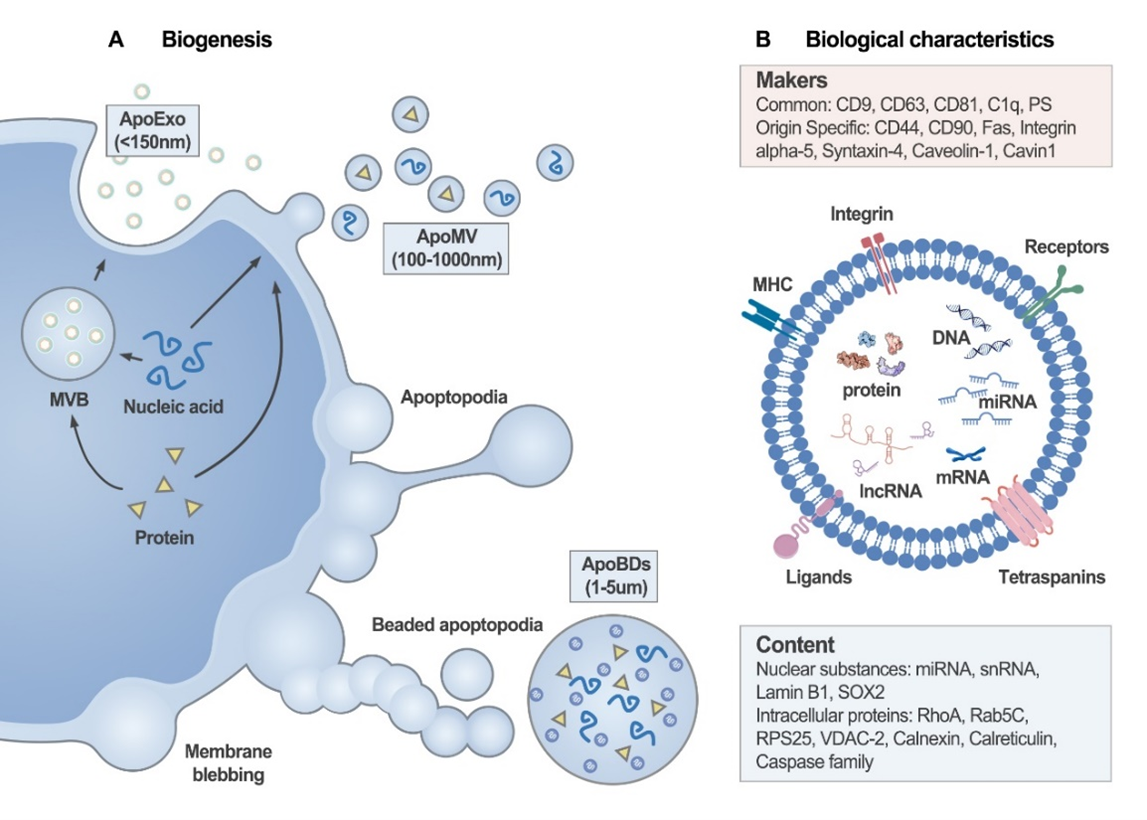
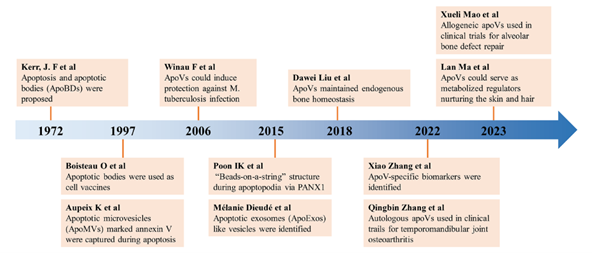
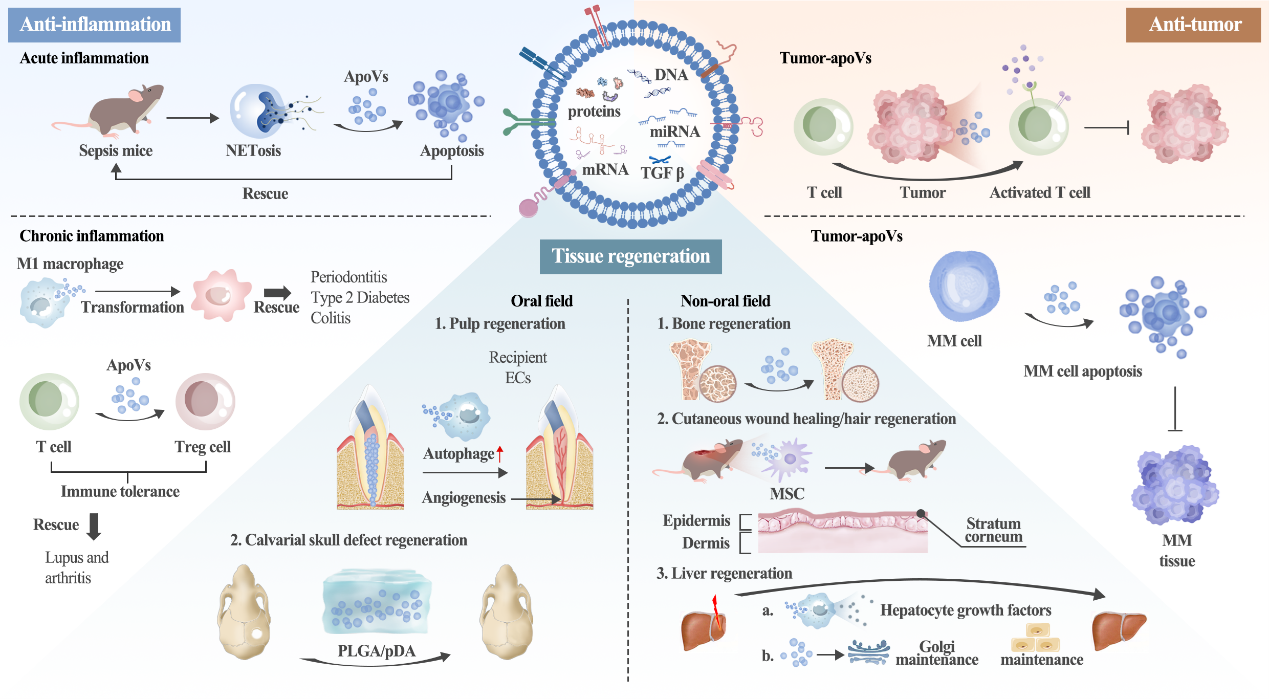
目前,ApoVs可分为三种亚类(图1),分别为:apoptosis bodies (apoBDs),apoptotic microvesicles (apoMVs)和apoptotic exosomes (apoExos)。三种亚类主要体现为直径区别:apoBDs直径为1-5μm,apoMVs直径为0.1-1μm,apoExos直径为30-50nm。诱导方法包括血清饥饿诱导,星形孢菌素药物诱导和紫外线诱导等。标志物包括常规囊泡标志物(CD63, CD9和CD81等)以及凋亡相关标志物(Annexin V,C1q,TSP-1等)。1972年,Kerr, J. F等人提出了细胞凋亡和凋亡小体等概念,开创了细胞凋亡和ApoVs等领域的研究(图2)。2006年,Winau等人发现结核分枝杆菌感染的巨噬细胞来源的ApoVs可激活CD8+T细胞以抵御结核分枝杆菌的感染。2018年,柳大为等人发现间充质干细胞来源的ApoVs对机体骨稳态维持具有重要作用,奠定了间充质干细胞来源ApoVs治疗功能的研究基础。目前,ApoVs广泛应用在口腔和非口腔等领域(图3)。在口腔领域中,ApoVs可用于治疗慢性牙周炎及口颌面部的组织再生;如人牙髓干细胞来源的ApoVs可通过增强内皮细胞的血管生成能力来促进犬模型根管内牙髓的原位再生[6],而局部移植干细胞来源的ApoVs可通过促进内源性骨髓间充质干细胞的活力来促进颅骨缺损模型中的骨再生[7]。ApoVs临床研究方面,2022年,广州医科大学张清彬教授课题组将ApoVs应用于颞下颌关节炎临床病人的研究(ChiCTR ID: 2200063153)。2023年,中山大学附属口腔医院毛学理教授课题组将ApoVs应用于拔牙窝止血和牙槽骨再生的临床研究(NCT No. 05971342),这些临床研究体现了ApoVs在口腔疾病的广阔应用前景。Apoptotic Vesicles: Therapeutic Mechanisms and Critical Issues, J Dent Res. 2024 Sep 13:220345241265676. doi: 10.1177/00220345241265676.外泌体资讯网 Journal of Dental Research|中山大学附属口腔医院施松涛教授团队:凋亡囊泡的治疗机制和关键问题