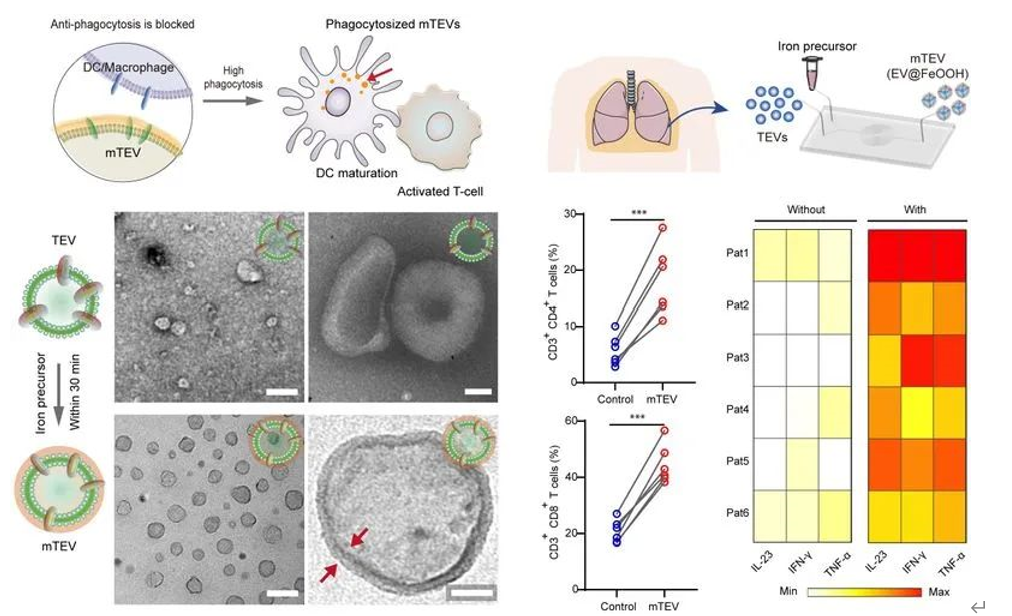
近年来,自体免疫疗法因其相对安全和高效的优势,在肿瘤治疗领域受到广泛关注,不断推动肿瘤治疗模式的革新。此疗法主要通过从患者体内提取免疫细胞,再经过一系列复杂的实验室处理,将这些细胞重新注入患者体内,以激发免疫系统对肿瘤的攻击。尽管这种方法有效,但由于其制备过程耗时、工艺复杂,且需要昂贵设备,导致治疗费用高昂,严重制约了获益群体。与通过基因工程手段在体外改造免疫细胞相比,设计自体肿瘤疫苗以在体内激活免疫细胞,成为一种有前景的免疫治疗策略。肿瘤细胞能够源源不断、高产率生成和释放囊泡到组织液和体液中,且囊泡收集相对简单,可以从临床切除的组织或者直接从患者的生理、病理体液中如恶性腹水或胸腔积液大量提取。因此,利用癌性囊泡制备自体肿瘤疫苗,用于免疫疗法具有很大优势。近日,南京邮电大学有机电子与信息显示国家重点实验室及化学与生命科学学院汪联辉教授、丁显光教授团队与新加坡国立大学David Tai Leong团队合作,在自体肿瘤疫苗领域取得进展,研究团队采用化学生物学手段,在微流控芯片上设计了一种适用于癌性囊泡的可逆免疫信号封装方法,来调控免疫细胞对癌性囊泡的识别。研究结果以”Non-discriminating engineered masking of immuno-evasive ligands on tumour-derived extracellular vesicles enhances tumour vaccination outcomes.”为题,发表在Nat. Nanotechnol上。这种技术能够提高免疫细胞对癌性抗原的摄取和活化,进而增强对肿瘤的杀伤效果,并在胸水模型中得到了初步验证。
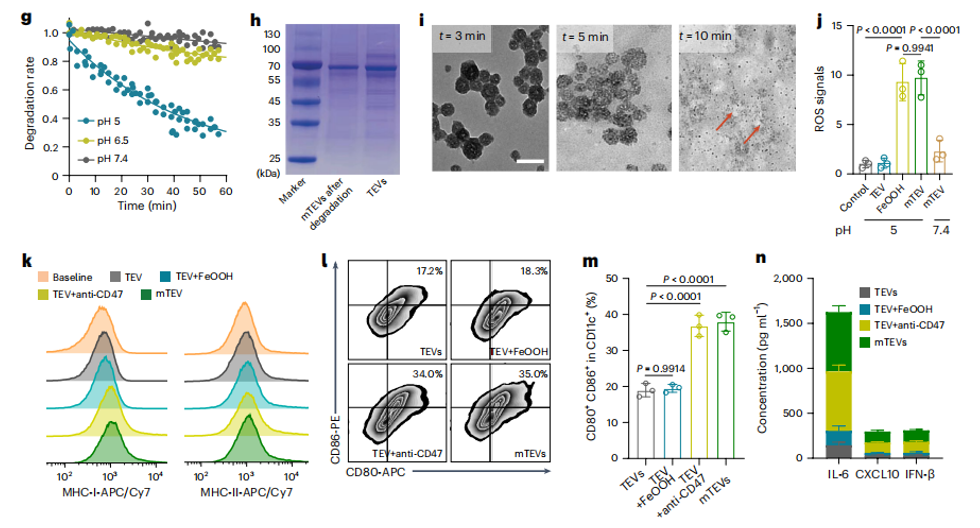
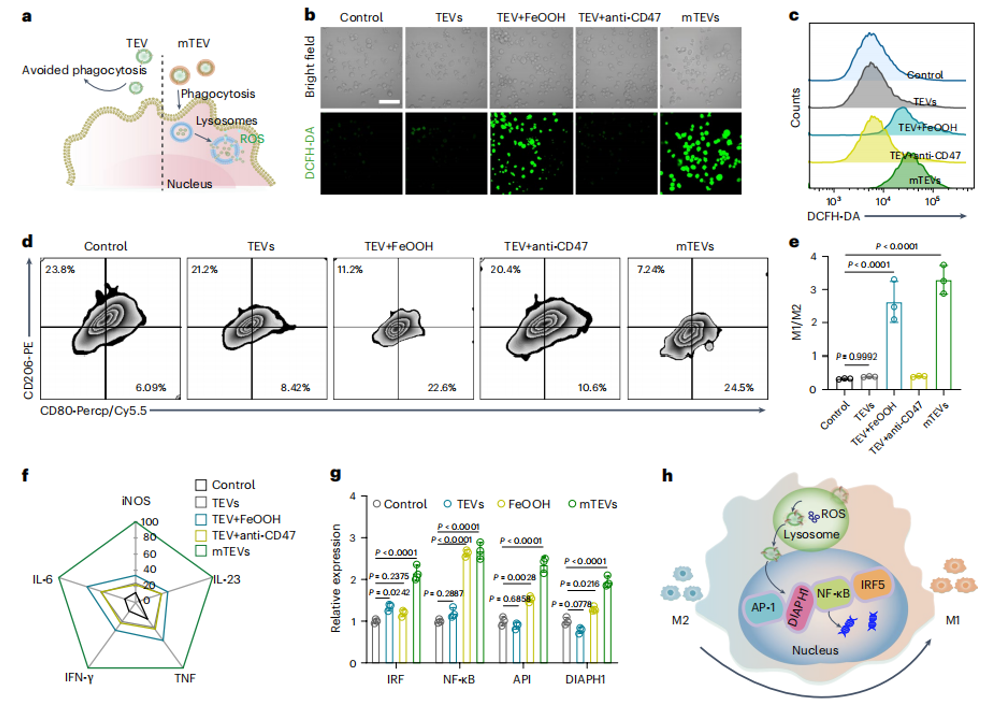
团队前期对生物囊泡材料的成分解析、有效利用进行了系列研究(Anal. Chem. 2022, 14794; Adv. Sci. 2023, 2204814; ACS Nano 2024, 9613; Nature Communications 2024, 3343),最新研究发现,癌细胞释放的囊泡表面可能携带免疫逃逸分子,这些分子干扰了免疫细胞的吞噬信号,导致免疫细胞无法摄取癌性抗原,进一步影响其有效识别和攻击肿瘤。因此,调控免疫细胞与癌性囊泡之间的生物信号识别,成为有效利用癌性囊泡抗原,研发自体肿瘤疫苗的关键。图1发展基于肿瘤囊泡的生物信号调控策略,开发高特异性自体肿瘤疫苗图2 封装的肿瘤囊泡mTEV促进DC细胞成熟和抗原呈递研究表明水合氧化铁(iron oxide hydroxide)纳米复合材料可以掩盖肿瘤囊泡表面CD47免疫逃逸蛋白并解除免疫细胞对肿瘤抗原吞噬作用的阻碍,同时不影响肿瘤囊泡激活免疫。封装的肿瘤囊泡mTEV被内化后,该水合氧化铁壳层可在溶酶体中分解,释放ROS促进巨噬细胞极化,同时暴露处内部的肿瘤抗原物质触发树突细胞抗原呈递,激活全身免疫。同时在动物模型和人类恶性胸腔积液临床样本中观察到树突状细胞的活化和成熟以及巨噬细胞的重编程,可有效抑制肿瘤进展和转移。这种直接的封闭策略消除了临床样本中普遍存在的抗吞噬阻断现象,可以应用患者特异性TEV作为自体肿瘤疫苗用于肿瘤免疫治疗。Non-discriminating engineered masking of immuno-evasive ligands on tumour-derived extracellular vesicles enhances tumour vaccination outcomes.Nat. Nanotechnol. (2024). doi:10.1038/s41565-024-01783-2.原文链接:https://doi.org/10.1038/s41565-024-01783-2.外泌体资讯网 Nat Nanotechnol|南京邮电大学汪联辉/丁显光/新加坡国立大学合作:纳米封装的肿瘤囊泡用作自体肿瘤疫苗