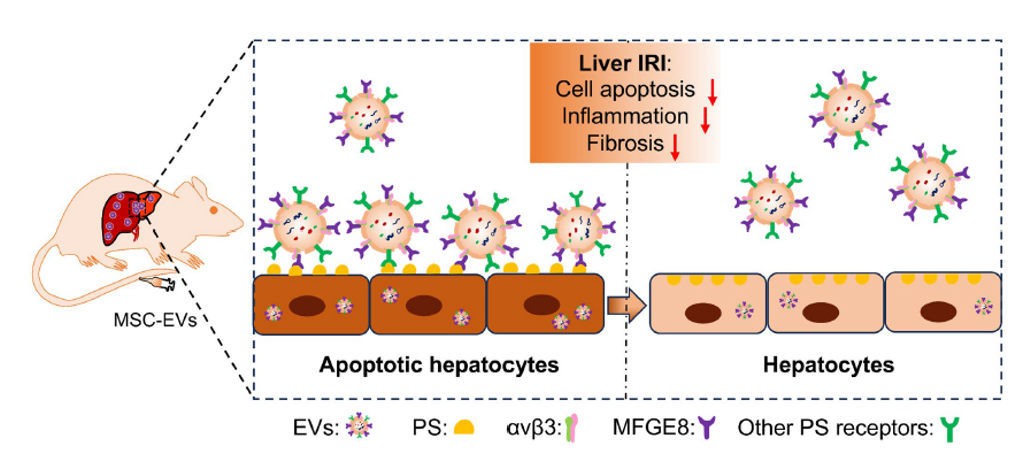
肝缺血再灌注损伤(IRI)是肝脏手术后肝功能障碍、肝功能不全和死亡的主要危险因素,以炎症级联反应和广泛的肝细胞凋亡为特征。目前研究表明,细胞外囊泡(EVs)通过与靶细胞的融合,释放携带的系列核酸和蛋白质等生物信号分子,调节靶细胞基因的表达或特定信号通路,进而影响靶细胞表型。间充质干细胞来源的EVs(MSC-EVs)具有改善肝IRI病理损伤、促进IRI肝再生的治疗效果。探究MSC-EVs在IRI肝脏中的靶细胞、摄取机制将有助于推动基于MSC-EV的肝脏IRI无细胞治疗的临床转化和应用。近日,南开大学医学院李宗金/解放军总医院第三医学中心陈小鸟团队在Apoptosis杂志上发表题为“Phosphatidylserine-mediated uptake of extracellular vesicles by hepatocytes ameliorates liver ischemia-reperfusion injury”的论文,主要介绍了静脉输注MSC-EVs在肝缺血再灌注损伤小鼠模型中的生物分布、靶向细胞、及介导其摄取的特定分子。
研究团队首先运用小动物活体成像观察了静脉注射的MSC-EVs在肝IRI小鼠模型中的实时生物分布。研究结果证明,MSC-EVs在肝IRI小鼠体内的生物分布发生改变——向损伤肝脏的归巢增多,而且损伤肝细胞对MSC-EVs的摄取能力增强。进一步研究发现,早期凋亡肝细胞表面的磷脂酰丝氨酸(Phosphatidylserine,PS)介导了肝细胞对MSC-EVs的内化,这可能是通过早期凋亡肝细胞表面的PS与MSC-EVs膜表面蛋白MFGE8相互作用实现的。此外,MSC-EVs部分依赖早期凋亡肝细胞表面PS介导的摄取方式发挥肝脏保护作用(图1)。该研究为肝IRI靶向分子的开发和基于MSC-EVs的无细胞治疗应用提供了新思路和可能策略。图1 MSC-EVs在IRI肝脏中积累增多。凋亡肝细胞表面的PS可能通过与MSC-EVs上富集的MFGE8相互作用介导MSC-EVs的内化文章第一作者为南开大学医学院博士研究生李容容,通讯作者为南开大学医学院李宗金、解放军总医院第三医学中心陈小鸟。Phosphatidylserine-mediated uptake of extracellular vesicles by hepatocytes ameliorates liver ischemia-reperfusion injury. Apoptosis. https://doi.org/10.1007/s10495-024-02030-8.外泌体资讯网 Apoptosis|南开大学医学院李宗金/解放军总医院第三医学中心陈小鸟:肝细胞磷脂酰丝氨酸介导的EVs内化改善肝缺血再灌注损伤