人工细胞的发展为理解活细胞的功能过程提供了基本的见解,同时为生物技术和医学的变革性应用铺平了道路。合成人工细胞的一种常见方法是将蛋白质表达系统封装在脂质囊泡内。然而,为了与外部环境进行交流,蛋白质必须跨越脂质膜进行转位。在活细胞中,膜内的蛋白质运输依赖于复杂的转位酶系统,而这些系统难以重构到人工细胞中。因此,需要简单的机制,使得蛋白质能够在合成细胞内编码和表达,同时仍能在外部展示。
来自美国加州大学的研究人员提出了一种基于孔形成蛋白突变体的基因编码膜功能化系统。他们修改了α-溶血素的膜转位环,以便将功能肽转位至脂质膜内,肽链长度可达52个氨基酸。在没有任何转位酶机械装置的情况下可以完成完全的膜转位,转位的肽链可以被对侧膜上的特定肽结合配体识别。工程化的溶血素可以用于基因编程人工细胞,展示相互作用的肽对,从而使其组装成类组织的人工结构。相关内容以“Encoding extracellular modification of artificial cell membranes using engineered self-translocating proteins”为题在线发表于10月30日的国际知名综合性期刊Nature Communications杂志上。
活细胞通过磷脂膜进行区室化,这些膜将细胞内容物与细胞外环境分隔开,并提供对细胞生存和身份至关重要的屏障。然而,脂质屏障也限制了细胞与细胞外环境的相互作用和通信,因为细胞膜通常对大多数生物分子不具渗透性。为了解决这个问题,细胞进化出许多复杂的机制,以便修改和功能化其膜结构。这种功能化通常是通过插入跨膜蛋白来实现的,这些蛋白在细胞内外环境之间起到连接作用,并促进营养物质的摄取、信号传递和组织形成。由于膜蛋白的两亲性,它们很少会自发插入膜中。相反,这些蛋白在膜内的正确拓扑结构和折叠依赖于高度进化的细胞转位酶系统。一个重要的例子是Sec61依赖的蛋白质转位通路,其中几个蛋白形成转位通道,使蛋白质能够穿越膜插入。
最近,开发人工细胞作为模仿活细胞结构和功能的模型的兴趣日益增加。生成人工细胞的最常见方法可能是将蛋白质封装在由磷脂膜组成的囊泡内。经过数十年的进展,研究人员能够常规形成膜结合囊泡,甚至封装细胞外蛋白合成所需的生物成分。然而,和活细胞一样,人工细胞的脂质膜构成了一个屏障,阻止内部表达的蛋白质与其他细胞或外部环境的相互作用。鉴于膜蛋白在活细胞中的重要性,迫切需要简化机制,使得在囊泡内内部表达的蛋白质能够嵌入膜中,从而使蛋白质能够穿越磷脂双层。如果蛋白质的很大一部分暴露在外层,人工细胞的外部环境就可以进行相互作用。
尽管在原始细胞中重构自然蛋白质插入机械装置方面取得了一些进展,但这种方法仍然非常复杂且效率有限。作为替代,研究人员开发了通过在膜中掺入亲和配体来功能化人工膜的方法。该配体可以作为一个手柄,通过它可以使用带有适当配体结合基团的蛋白质对膜进行化学功能化。然而,在自然细胞中,膜的修饰是作为细胞基因组的一部分自我编码的。此外,已有研究表明,在脂质双层存在的情况下使用体外表达系统可能导致某些膜蛋白自发插入脂质双层。然而,目前尚不清楚这种原位膜蛋白插入过程是否导致脂质双层的完全转位,或者这些蛋白是否能够介导细胞外相互作用。
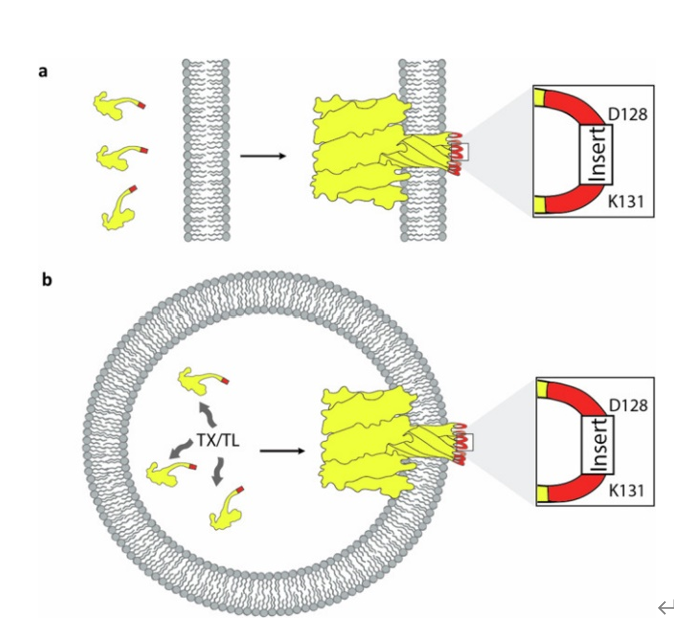
一种能够利用基因编码蛋白质对单个人工细胞进行外部膜修饰的策略是利用能够自我转位穿越脂质膜的可溶性蛋白。有一些罕见的蛋白质例子,例如孔形成毒素(PFTs),它们能够独立于任何插入机械装置自我插入生物膜。一个被广泛研究的PFT例子是细菌毒素α-溶血素(αHL)。当αHL首先作为可溶单体结合到膜上时,孔的形成发生,然后形成七聚体复合物,自发地以桶状结构穿越脂质膜。由于其在感染中的生物学作用和在纳米孔测序中的应用,αHL得到了广泛的研究。由于其自我插入和孔形成能力,αHL也被用于人工细胞系统中,使脂质膜对小分子具有渗透性,从而促进内部生化反应,如转录和翻译。多项开创性研究表明,αHL可以在多个位置突变而不失去其孔形成活性。
尽管αHL的组装导致跨膜蛋白的自发形成,但在孔形成时,每个单体的非常小的区域完全穿越脂质膜,即由氨基酸128-131形成的环。如果氨基酸128-131被修改为包含肽标签或其他小蛋白,同时仍允许αHL孔的组装和插入,则内部表达工程化溶血素的人工细胞将外部显示肽标签,这些标签随后可以与外部环境相互作用。研究人员设想,这个系统将构成一种在人工细胞中实现自我编码细胞外膜功能化的简单方法。
在这项研究里,研究人员证明了长度可达52个氨基酸的功能性肽可以插入环128–131,而不会破坏αHL的膜插入和孔形成能力。研究人员筛选不同大小的肽,以确定插入类型。遇到合成膜一侧的αHL蛋白可以自发地将肽表位转位穿越膜,并与另一侧的肽结合抗体相互作用。通过在巨型单层囊泡(GUVs)中表达基因编码的修饰αHL,形成能够在其细胞外膜上自我展示肽的人工细胞。通过混合展示相互作用肽的人工细胞群体,研究人员展示了自我编码的类组织结构的形成。最后,研究人员展示了自我编码的人工组织形成是模块化的,并且可以与其他功能系统结合。
参考文献:Encoding extracellular modification of artificial cell membranes using engineered self-translocating proteins. Nat Commun. 2024;15(1):9363.