肠道微生物群不仅在维护我们的健康中扮演着关键角色,它们还直接影响着我们的免疫系统,与免疫相关疾病的发生息息相关。肠道菌群的组成及微妙平衡,以及肠道屏障的完整性,都可能因为炎症而受到干扰。银屑病患者尤其值得关注。他们表现为包括肠道炎症在内的多器官炎症,肠道微生物多样性降低,某些细菌类群的相对丰度异常,这可能与慢性炎症的发生有关。特别是,银屑病患者的肠道细菌群中,厚壁菌门和放线菌门占主导地位,而副拟杆菌属的丰度显著下降,这可能影响了有益代谢物的产生,导致慢性炎症。
近期,中山大学药学院(深圳)程芳/陈红波教授团队在Journal of Controlled Release (IF=10.5,中科院1区)杂志上发表题为“Gut commensal bacteria Parabacteroides goldsteinii-derived outer membrane vesicles suppress skin inflammation in psoriasis”的研究,深入探讨了肠道共生细菌P. goldsteinii衍生的外膜囊泡(OMVs)通过传递关键的抗炎分子(例如十五烷酸)来调节宿主的免疫系统。这些OMVs能够在炎症皮肤区域积聚,有效抑制IL-23/Th17轴,改善全身免疫稳态,从而显著缓解银屑病症状。
该研究聚焦于金氏副拟杆菌(Parabacteroides goldsteinii,简称Pg),一种具有开发潜力的下一代益生菌。它已被证实能够显著改善肠道和肺部炎症。但在炎症性皮肤疾病中的作用,我们知之甚少。此外,活菌疗法可通过细菌干预和与宿主免疫细胞的相互作用来调节免疫系统,然而由于其固有的特性,活菌治疗面临许多局限性,存在不可控的风险,如胃肠道相关的不良反应、感染、有害的代谢影响、易感个体的过度免疫刺激以及潜在的宿主-微生物基因转移。
外膜囊泡(OMVs)作为一种新型的细菌-宿主细胞相互作用的中间体,因其体积小、无增殖潜力、生物相容性、高稳定性和靶标特异性等特性,成为了研究的热点。程芳/陈红波教授团队开发了一种规模化制备细菌囊泡的策略,能够大量提取金氏副拟杆菌的外膜囊泡(Pg OMVs),并发现这些囊泡能够有效抑制炎症反应,减少巨噬细胞M1极化和树突状细胞的成熟,降低炎症因子的释放,从而抑制Th1和Th17细胞的分化,降低角质形成细胞的增殖,同时还能够干扰巨噬细胞和角质形成细胞的相互作用。
通过蛋白质组学和代谢组学分析,作者发现Pg OMVs携带了多种生物活性物质,特别是富含十五烷酸这种奇链脂肪酸,在免疫调节中发挥了关键作用。更令人兴奋的是,Pg OMVs能够在恶劣的胃环境中存活,并穿越肠道屏障循环到炎症病损皮肤,有效减少表皮增生,抑制炎症细胞在皮肤病变处的浸润。此外,皮下注射装载Pg OMVs的热敏性PF-127水凝胶对局部皮肤和全身炎症也具有类似的调节作用,有效缓解银屑病的症状,并且展现了良好的治疗安全性。
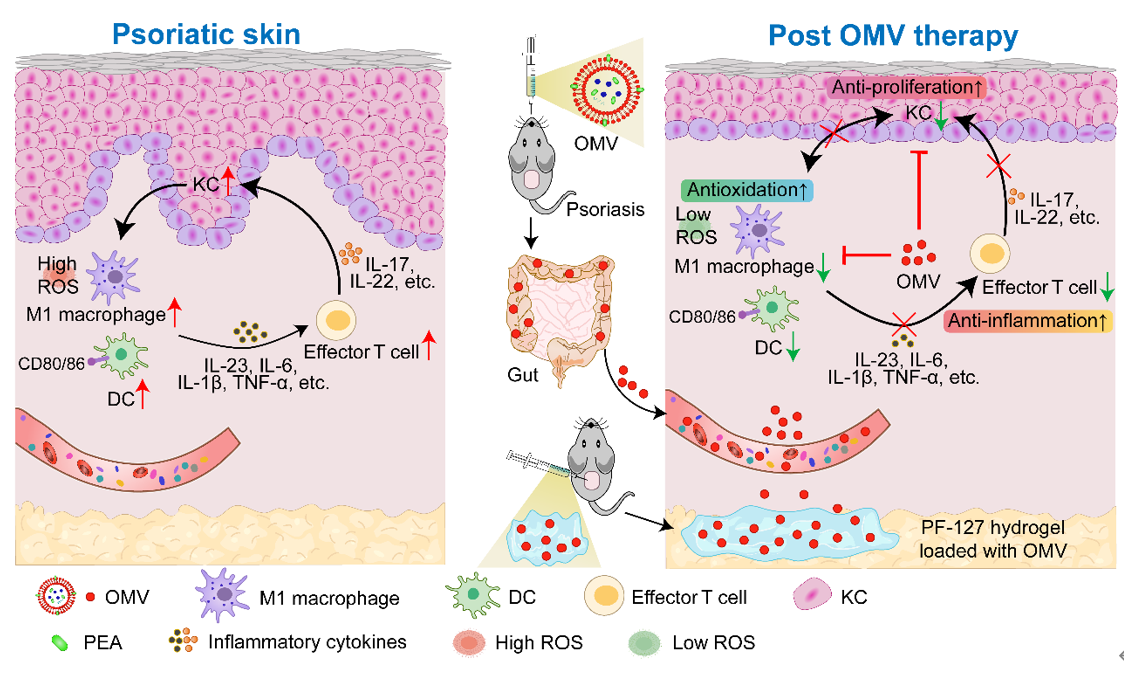
该研究不仅强调了肠道和皮肤微生物群中细菌OMVs的重要性,而且为开发新型免疫调节剂提供了新思路。这些OMVs有望成为活菌治疗的替代品,为炎症免疫性疾病的治疗开辟新途径。
中山大学药学院(深圳)博士研究生苏丹丹和硕士研究生李漫淳为这项研究的共同第一作者,程芳教授、陈红波教授及厦门长庚医院张志荣教授为共同通讯作者。该工作得到了国家自然科学基金、广东省自然科学基金等多个项目的支持。
参考文献:Gut commensal bacteria Parabacteroides goldsteinii-derived outer membrane vesicles suppress skin inflammation in psoriasis. Journal of Controlled Release. 2024 Nov 18;377:127-145.文章链接:DOI:10.1016/j.jconrel.2024.11.014
外泌体资讯网 J Control Release|中山大学药学院程芳/陈红波:肠道微生物的神奇力量:口服或局部注射肠道细菌外膜囊泡可对抗银屑病





