细胞外囊泡(EVs)作为新型治疗剂,特别是在癌症和退行性疾病中,正逐渐受到关注。然而,从市场和临床的角度来看,仍然需要使用较少的细胞材料高产量生产EV的方法。来自法国巴黎文理研究大学的研究人员提出使用毫流控交叉槽芯片来触发细胞外囊泡生产,利用对涡流强度和涡流流动模式的直接控制。在涡流中运输的生物材料可以在显微镜下直接可视化,从而定量分析涡流对细胞的影响。具体而言,该交叉槽芯片展示了从由人类间充质干细胞组成的球体中高效生物生产细胞外囊泡,同时以最少数量的生产细胞进行操作。此外,得益于对流体动力学条件的精确控制,它提供了对细胞外囊泡释放机制基础的全面探索。该研究证明了对细胞球体施加短暂而强烈的应力足以诱导细胞外囊泡的大量释放。相关研究以“High-Yield Bioproduction of Extracellular Vesicles from Stem Cell Spheroids via Millifluidic Vortex Transport”为题在线发表于11月12日的国际知名材料化学学术期刊Advanced Materials杂志上。
细胞外囊泡(EVs)作为由生物膜包围的纳米级关键载体,正逐渐被认识为广泛的细胞间通信系统中的主要参与者。细胞外囊泡由所有类型的细胞分泌,并存在于所有生物液体中,促进了包括蛋白质、代谢物和核酸在内的复杂货物的交换。它们的生物生成途径与许多调控细胞行为的生理和病理过程密切交织,使其成为关键的细胞功能调节因子。细胞外囊泡在疾病的启动和进展中也发挥着重要作用。总体而言,细胞外囊泡已显示出其在调节免疫反应、影响组织修复和再生、促进新生血管生成、抑制器官纤维化,以及促进癌症进展和转移、神经退行性疾病或心血管病理中的参与角色。
细胞外囊泡能够反映其生产细胞的功能,以及其被工程化以增强治疗潜力的能力,使其成为无细胞治疗的有前途的候选者,为传统的基于细胞的方法提供了替代方案,并且是非侵入性生物标志物的来源。因此,过去十年对细胞外囊泡的研究呈指数增长,2022年注册了116项临床试验。然而,实现细胞外囊泡全部治疗潜力的一个重大障碍在于生产足够数量的细胞外囊泡并确保临床兼容的质量。这需要我们对细胞外囊泡释放的理解和控制的进步,以及开发创新和高效的生物过程。目前广泛使用的生产方法利用饥饿、pH、缺氧或化学激活诱导细胞外囊泡释放。然而,这些方法每个生产细胞产生的细胞外囊泡数量较低。扩大培养系统,使用超大培养瓶、中空纤维生物反应器或在搅拌罐生物反应器中使用微载体进行细胞培养,使操作员能够通过增加生产细胞的数量来提高细胞外囊泡的数量,但仍然需要大量的细胞材料进行操作,并且对生产过程的控制不可行。
为了满足从有限数量的生产细胞中生产足够数量细胞外囊泡以用于临床应用的需求,因此必须提高每个细胞的产量。为应对这些需求,已提出基于流体动力学的方法来增加每个细胞的细胞外囊泡生产。其合理性在于机械力被认为是细胞行为的关键调节因子,影响从细胞分化到组织发育、组织修复、免疫系统调节甚至细胞死亡等过程。在这些基础上,机械或粘性应力自然被研究作为细胞外囊泡释放的刺激,确实展示了一些囊泡生产产量的提升。然而,现有技术,如在高速搅拌罐中诱导的剪切应力生产,存在显著缺陷。虽然每个细胞的细胞外囊泡产量高,但这些生物反应器中的细胞外囊泡生产技术仍然受到对大量生产细胞的依赖、与3D配置相比在珠子上培养的细胞的生物相关性较低以及无法精确控制施加于细胞材料的应力的限制。因此,仍然需要一种方法,不仅增强细胞外囊泡生产的产量和适应性,还能够控制流体动力学条件。这对于理解机械力与细胞外囊泡释放的复杂生物过程至关重要。
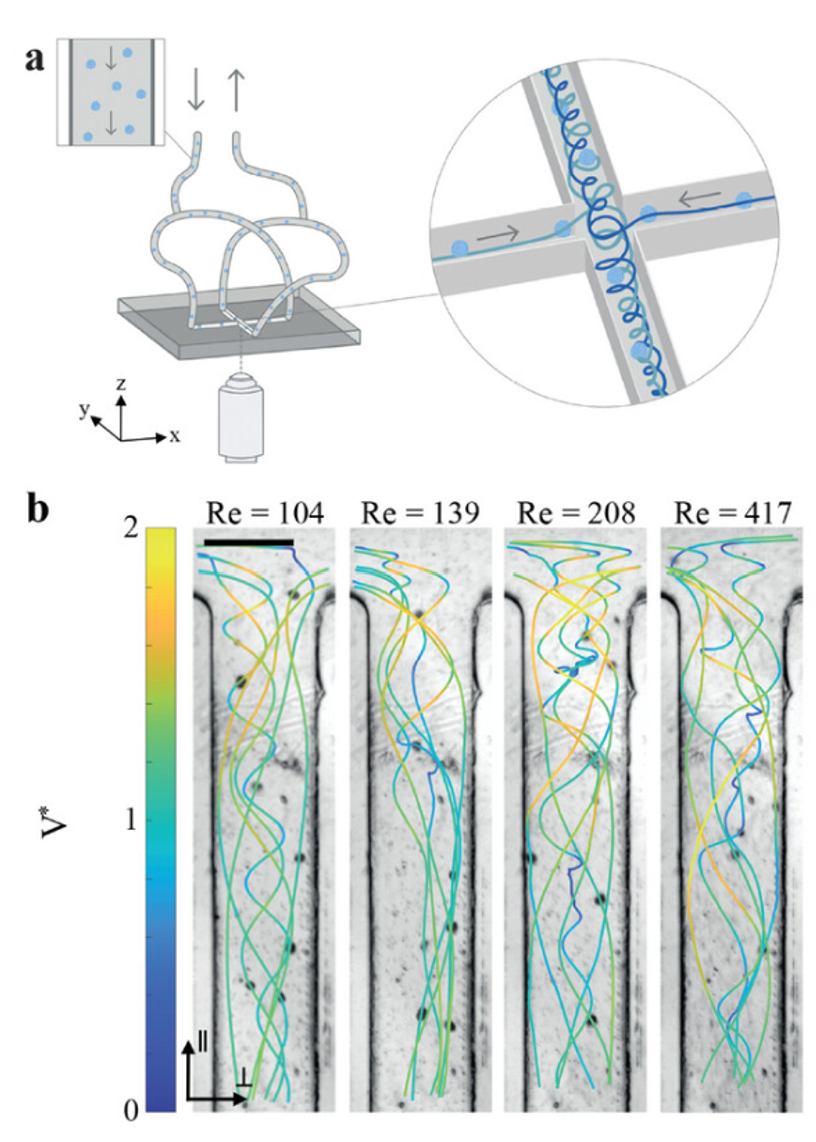
最近成功用于细胞外囊泡生产的基于流体动力学的技术依赖于湍流状态,其特征是不同大小和强度的涡流。因此,研究人员提出了一种毫流控(Millifluidic )交叉槽芯片,以诱导从不到三百万个细胞中释放生物活性细胞外囊泡的高产量。根据流速,出口通道中形成一个单一涡流,使运输的细胞材料暴露于高粘性应力下。重要的是,该芯片能够在生理环境中容纳生产细胞,例如人类间充质干细胞(hMSCs)球体,同时便于在涡流中对其进行可视化和单独跟踪。这种在球体水平上对粘性应力的精确控制使得每个细胞释放多达30000个细胞外囊泡,雷诺数约为400,而不损害细胞完整性。此外,它揭示了启动细胞外囊泡生产的阈值,提供了证据表明存在一种应力依赖机制来调控囊泡分泌。在高雷诺数下大规模生产的细胞外囊泡显示出促血管生成和伤口愈合的能力,经过其货物的蛋白质组学和细胞计量分析得到了证实。这些细胞外囊泡与单层细胞来源的细胞外囊泡相比,具有不同的分子特征,突显了生产方法和三维细胞环境在细胞外囊泡生成中的关键作用。
参考文献:High-Yield Bioproduction of Extracellular Vesicles from Stem Cell Spheroids via Millifluidic Vortex Transport. Adv Mater. 2024 Nov 12:e2412498.