细菌外泌体是一类微小的囊泡结构,在细菌生长的各个阶段均可分泌,其在细胞间的信息传递、生物物质转运以及与宿主之间的相互作用中扮演着重要角色。和细胞外泌体不同的是,细菌外泌体表面有着丰富的脂多糖等分子,膜蛋白标志物复杂多样,但是目前尚无高效的细菌外泌体分离手段。
近日,吉林大学胡良海教授课题组开发了针对脂多糖分子的分子印迹人工抗体,可对革兰氏阴性细菌的外膜囊泡(OMVs)进行特异性识别和分离,研究成果以“Lipopolysaccharide Imprinted Polymers for Specific Recognition of Bacterial Outer Membrane Vesicles”为题在Analytical Chemistry在线发表。
细菌外膜囊泡(OMVs)是革兰氏阴性菌特有的分泌物,主要由细菌的外膜组成,其粒径范围为20-300 nm。这些囊泡含有多种与细菌膜相关的蛋白质、脂质和核酸,其不仅参与细菌与宿主细胞之间的相互作用,还在细菌间的信息交流和基因转移等过程中发挥重要功能。此外有研究表明OMVs还参与多种疾病发生的潜在机制。OMVs由于携带各种信号分子,成为细菌感染或疾病检测的新兴诊断标记物。然而,患者的实际生物样本极其复杂,将OMVs应用于临床诊断仍然是一个重大挑战。主要挑战之一是OMVs的富集仍然存在很大的困难,包括步骤繁琐和浓度较低。而一些常用的外泌体富集方法,如超速离心(UC),仍然存在一些缺点。因此,胡良海教授课题组引入了脂多糖(LPS)分子印迹聚合物(MIP)来有效捕获和分析OMVs,从而实现基于生物识别材料的细菌性疾病诊断的新方法。这项研究采用TiO2纳米粒子作为LPS分子印迹识别的基底材料,LPS通过静电相互作用力在TiO2表面定向排列。MIP 的合成如图1A所示,通过逐层包覆合成含有印迹空腔的磁性纳米粒子。图1B展示了MIP的TEM图像,纳米粒子的外层是清晰的包覆层,证明TiO2和SiO2被成功包覆,粒径约为197 nm,DLS测定MIP的平均粒径为319 nm(图1E)。在 EDX 元素分析中,可以观察到 Fe、Ti、O 和 Si 被成功掺杂到磁性纳米颗粒中(图1C)。基于此结果,研究者进行了进一步的X射线光电子能谱(XPS)分析。 与EDX元素分析一致,成功检测到 Fe、C、C−O、Si 和 Ti(图1D)。不同阶段纳米颗粒的 zeta 电位如图1F所示。Fe3O4和Fe3O4@TiO2纳米粒子由于其表面的Fe3+和Ti4+而带正电,而MIP和NIP带负电。当MIP与LPS共孵育时,LPS的磷酸基团在TiO2层上定向排列,LPS上的中性多糖和疏水性脂肪酸链中和MIP的负电荷并带正电。
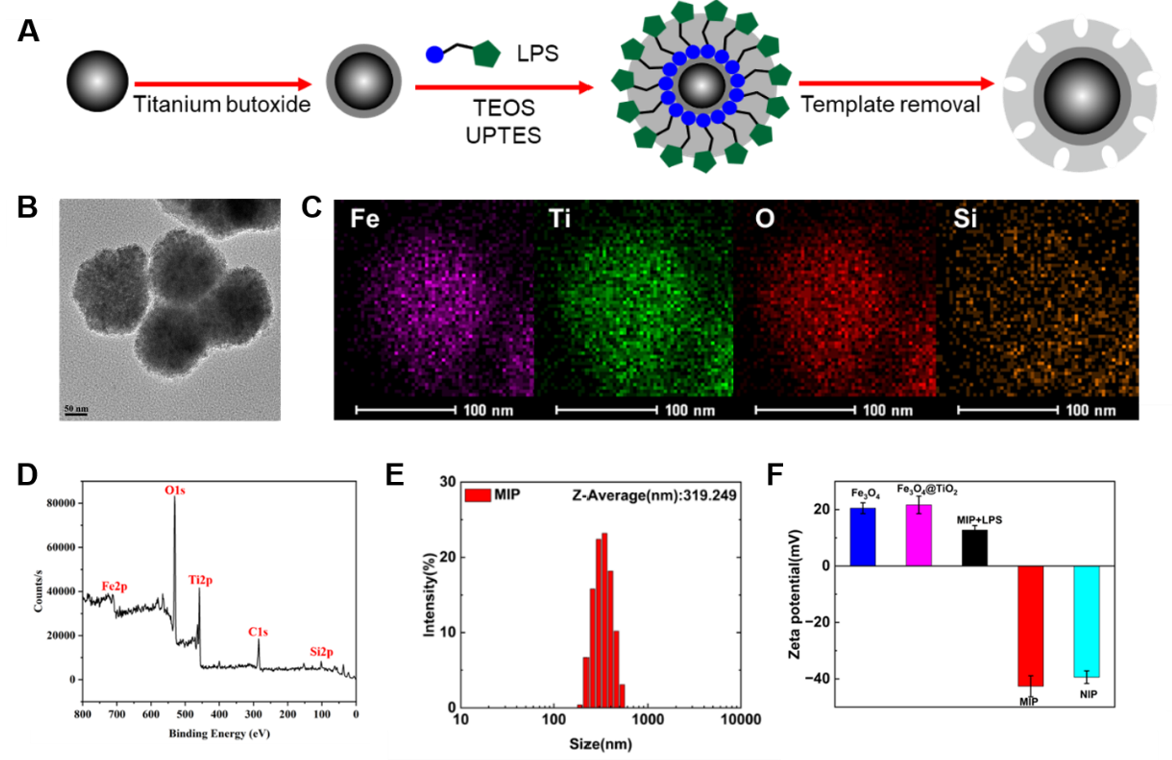
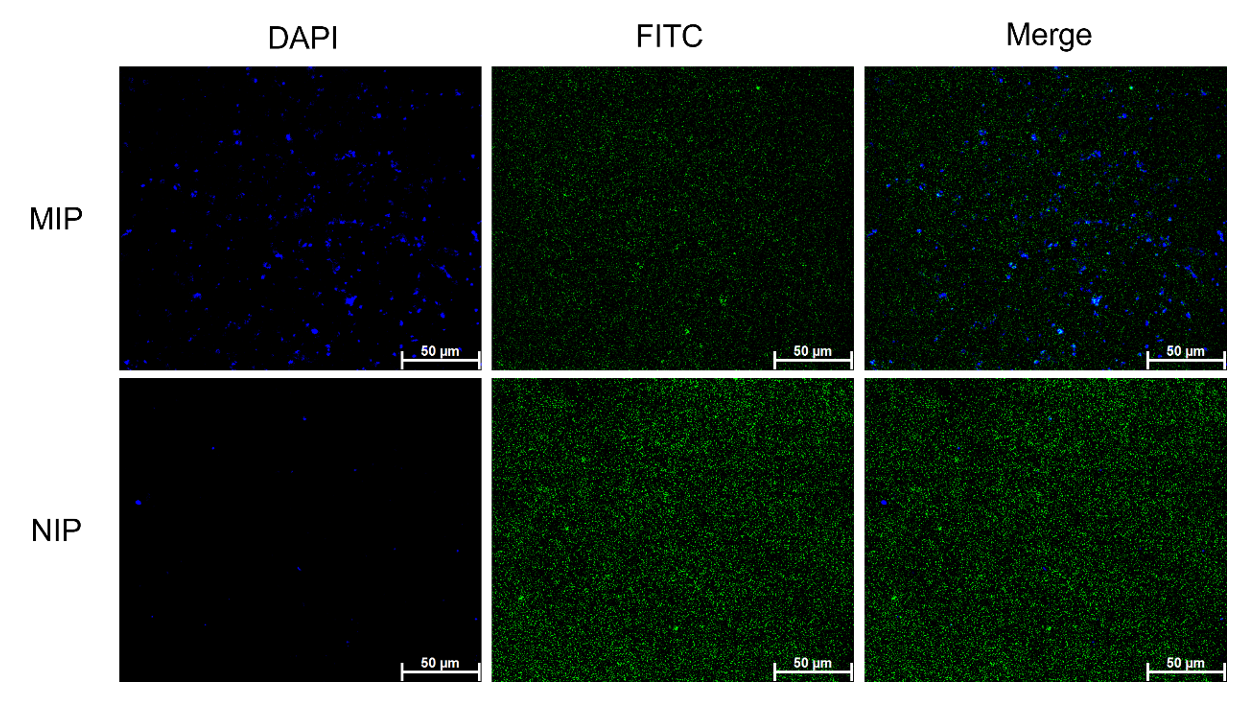
图1 分子印迹材料(MIP)的表征受MIP与LPS优异结合能力的启发,研究者通过将FITC-MIP/FITC-NIP与细菌共培养,探究了MIP 对大肠杆菌的靶向能力。如图2所示,FITC标记的纳米颗粒与DAPI标记的大肠杆菌一起表现出明显的荧光信号,这一结果直观地揭示了MIP的靶向效果。 值得注意的是,MIP组捕获的大肠杆菌数量显著超过NIP组,并且在蓝色荧光背景上清晰可见绿色荧光的分布,这一现象充分证明了MIP与大肠杆菌有很强的相互作用。
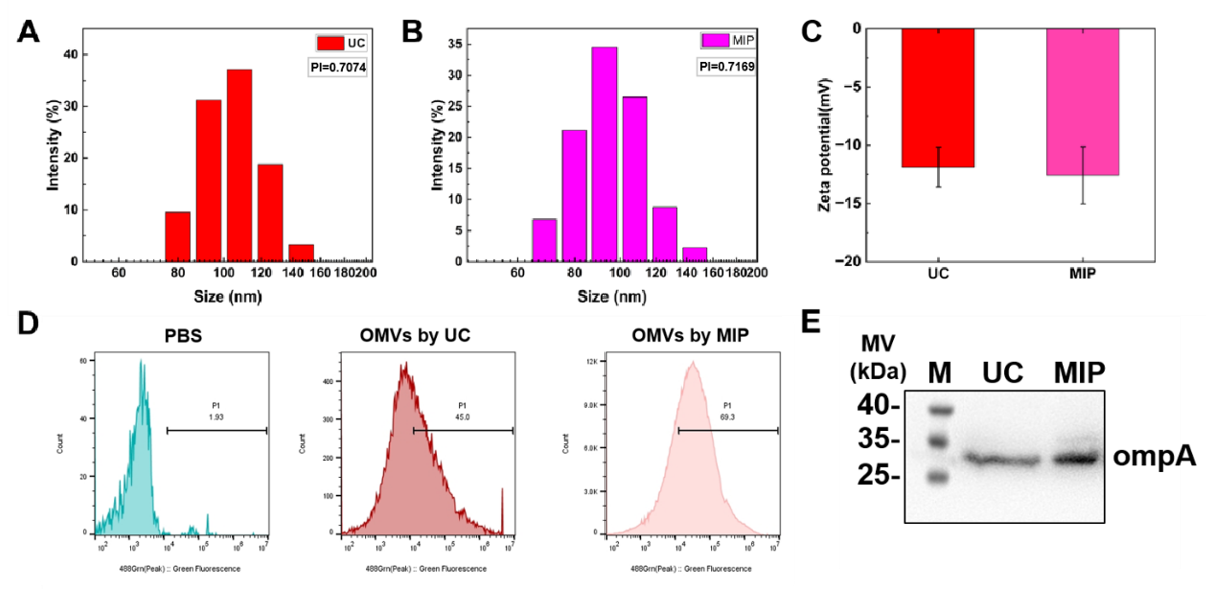
图2 MIP、NIP与E.coli相互作用的共聚焦显微成像超速离心是目前最常用的外泌体分离方法。然而,UC通常需要昂贵的超速离心仪器、较长的处理时间却获得较低的外泌体纯度。与UC相比,MIP富集OMVs具有更高的选择性、更简单的操作和更低的成本。研究者对MIP和UC捕获的OMVs进行了粒径和zeta电位的比较。DLS的结果显示两组囊泡的大小约为100 nm,它们的粒径分布以及zeta电位非常相似(图3A-C),这表明了MIP成功捕获OMVs。为了进一步评估OMVs的纯度,研究者使用基于纳米流式的荧光强度测量作为附加评估标准。如图3D所示,使用UC分离的外膜囊泡中只有45%表现出荧光标记,相比之下, MIP 从细菌培养上清液中分离出了更多数量的外膜囊泡。这一发现与Western Blot结果一致(图3E)。
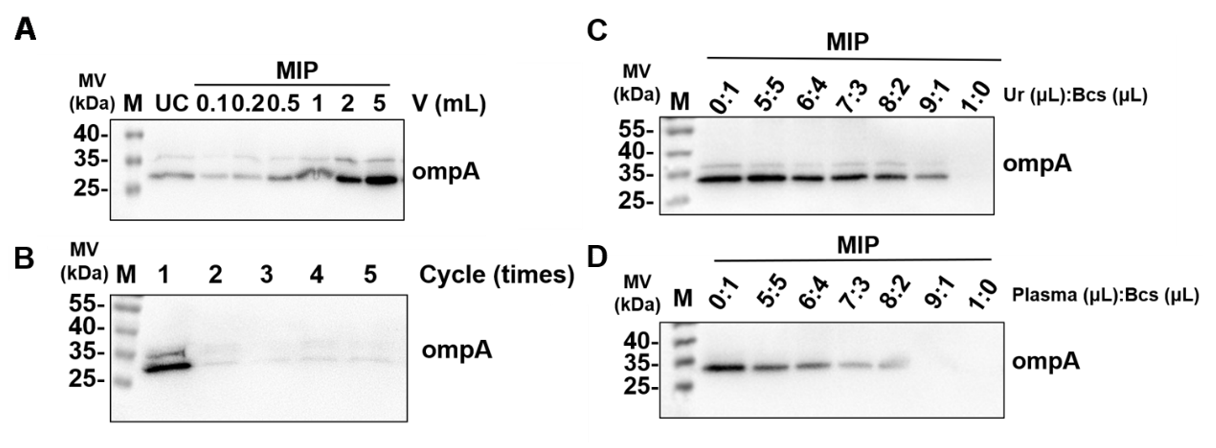
图3 MIP和UC富集的OMVs的比较将2 mg MIP与不同体积的细菌培养上清液(0.1、0.2、0.5、1和2 mL)共孵育,同时使用2 mL UC样品作为对照。结果显示,MIP对目标蛋白的富集随着细菌培养液体积的增加而成比例增加,仅用100 μL的细菌培养液便能达到可检测的信号水平,并且MIP富集的灵敏度是UC的4倍(图4A)。如图4B所示,通过对细菌培养上清液重复富集5次,可以观察到MIP对OMVs的回收率在90%以上,并且MIP富集的细菌培养上清液中几乎没有残留的OMVs,这直观展示了MIP在富集OMVs方面的高效性。基于优异的捕获性能和检测灵敏度,MIP有望用于疾病诊断。在尿液和稀释500倍的血浆样本中,按体积比(0:1、5:5、6:4、7:3、8:2、9:1、1:0)添加细菌培养上清液至总样本中(总体积为1 mL)。当尿液与细菌培养上清液的体积比为9:1,血浆与细菌培养上清液的体积比为8:2时,可以检测到信号,这证明了MIP在处理复杂生物样品,特别是血浆样品方面的潜在应用(图4C-D)。
图4 MIP富集OMVs的灵敏度与回收率为了评估MIP在检测OMVs方面的潜力,研究者利用其从大肠杆菌中捕获OMVs,之后进行蛋白质组学分析。结果显示(图5)OMVs中的多种蛋白质被成功捕获并分析,这为未来研究与OMVs相关的功能和生物过程提供了重要的见解。
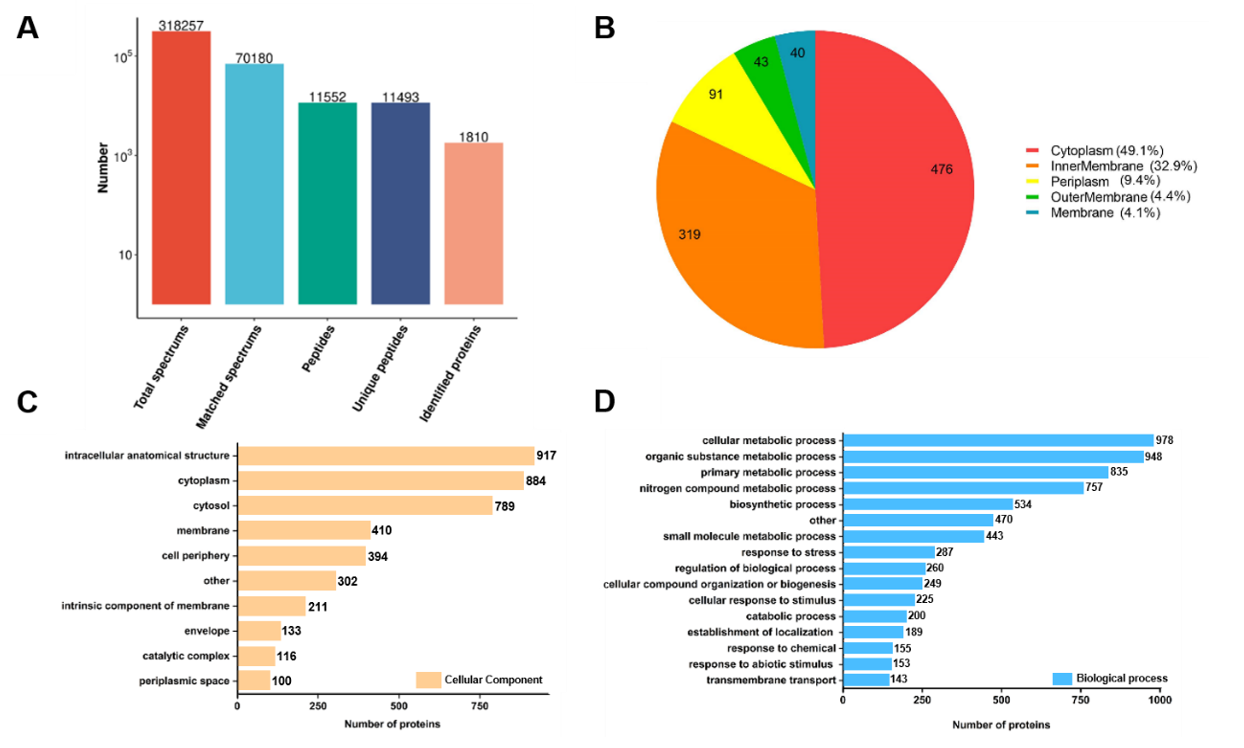
图5 OMVs的蛋白质组学分析吉林大学生命科学学院研究生李晓君、齐秀蕾为文章的共同第一作者,吉林大学生命科学学院胡良海教授为文章的通讯作者。该工作得到了国家自然科学基金和国家重点研发计划-人体蛋白质组导航项目(π-HuB项目)的资助。参考文献:Lipopolysaccharide Imprinted Polymers for Specific Recognition of Bacterial Outer Membrane Vesicles, Analytical Chemistry, 2024 Nov 21. doi: 10.1021/acs.analchem.4c05288.