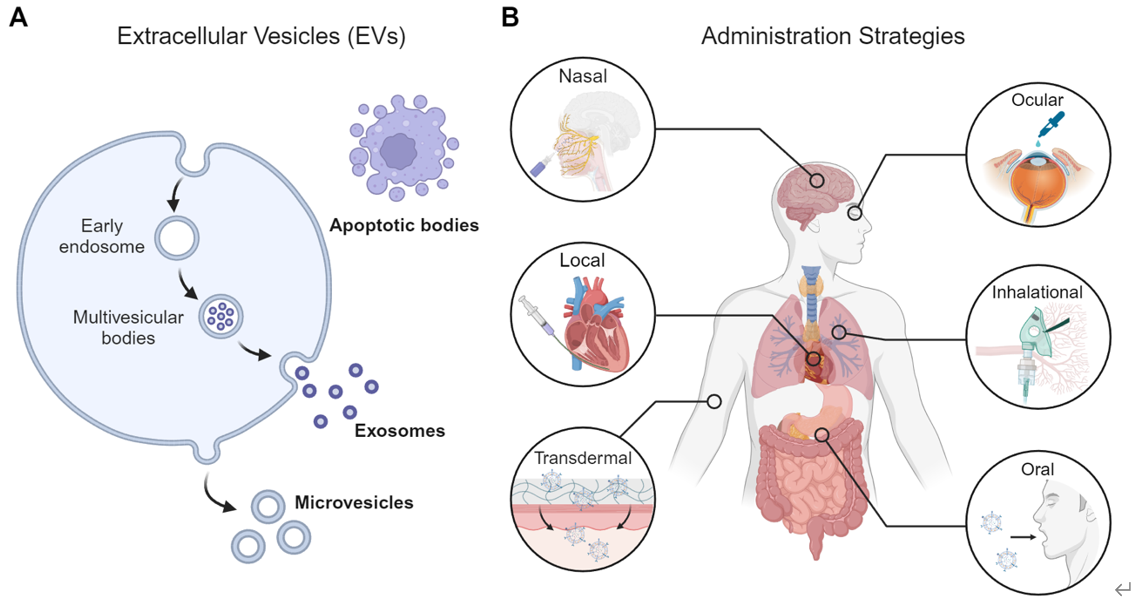
细胞外囊泡(EV)可以介导细胞间通讯,调节各种信号通路,因而具有极大的治疗价值。此外,EV具有优越的药物封装和递送能力,被认为是下一代药物递送纳米平台。EV的治疗效果与疾病部位靶细胞内化的 EV数量呈正相关,因此需要增强EV的组织特异性递送和延长 EV在疾病部位的滞留时间才能实现最佳治疗效果。目前,静脉注射是最常用的EV治疗给药策略。然而,静脉注射后的EV易被快速清除,并且会导致EV主要分布在非靶组织中,限制了EV的治疗效果。近年来,研究工作者提出了将 EV 靶向递送到特定组织的新型给药策略。这些EV新型给药策略通过改变药物释放和保留特性,优化了EV在特定组织中的生物利用度。同时,开发出一系列生物活性材料,以支持这些 EV新型给药策略并进一步增强 EV的治疗功能。使用这些 EV给药策略可以减少EV使用剂量而达到相同的治疗效果,从而降低医疗成本并最大限度地减少不良反应。近日,南方医科大学第十附属医院王飞博士及课题组成员总结了EV新型给药策略的开发及其在生物医学领域的应用,介绍和讨论了在脑、心脏、肺、皮肤、眼睛和胃肠道组织特异性EV 给药策略与生物材料相结合的最新进展。相关成果以“Novel administration strategies for tissue-specific delivery of extracellular vesicles”为题发表在Extracellular Vesicle(10.1016/j.vesic.2024.100057)。
文章针对脑、心脏、肺、皮肤、眼睛和胃肠道组织中的传统和新型给药策略进行了总结和比较。针对脑部给药,聚焦超声以及经鼻滴入是新型EV脑部给药途径,聚焦超声可以短暂打开血脑屏障,使EV通过血脑屏障进入脑部。而滴鼻剂则是通过被嗅神经和三叉神经摄入,从而运输至脑部,避开血脑屏障。针对心脏给药,心包腔(iPC)注射是一种不会损伤心肌层的注射方式,可通过微创方法实施;雾化吸入是一种新型的非侵入性给药途径,EV药物穿过气血屏障到达心脏;基于生物活性材料的递送策略也可用于治疗心脏损伤。针对肺部给药,吸入给药是最优选择,目前研究工作者已开发出多种基于EV的吸入疫苗。针对创面和皮肤疾病治疗,皮内 (i.d.) 注射和皮下 (s.c.) 注射是突破角质层皮肤屏障的直接方法,通过注射EV对抗脱发和皮肤衰老的临床研究已经开展;微针和无针注射也被证明是可以突破角质层的EV给药创新策略。针对眼部给药,局部滴眼液是一种更方便的眼部给药方法,目前已有临床研究使用含干细胞来源EV的滴眼液来治疗干眼症。针对胃肠道疾病治疗,口服给药无疑是一种有效且无创的肠道EV给药方法,有助于提高药物依从性。
综上所述,研究人员在EV组织特异性递送的新型给药策略领域取得了新进展。然而,在这些创新 EV 给药策略转化为临床实践之前,需要详细阐明EV的体内分布、脱靶效应及潜在的生理毒性,并进一步与医疗器械和生物材料领域的进展相互配合,扬长避短,最大化EV的治疗效果。该综述为 EV 疗法的临床应用提供了前瞻性观点。南方医科大学第十附属医院王飞博士为本文的通讯作者,南方医科大学第十附属医院博士研究生邓钧耀和硕士研究生李奇珊为本文共同第一作者。该研究得到了国家自然科学基金及东莞市社会发展科技项目的资助。参考文献:Novel administration strategies for tissue-specific delivery of extracellular vesicles. Extracellular Vesicle. 2024, 4, 100057.





