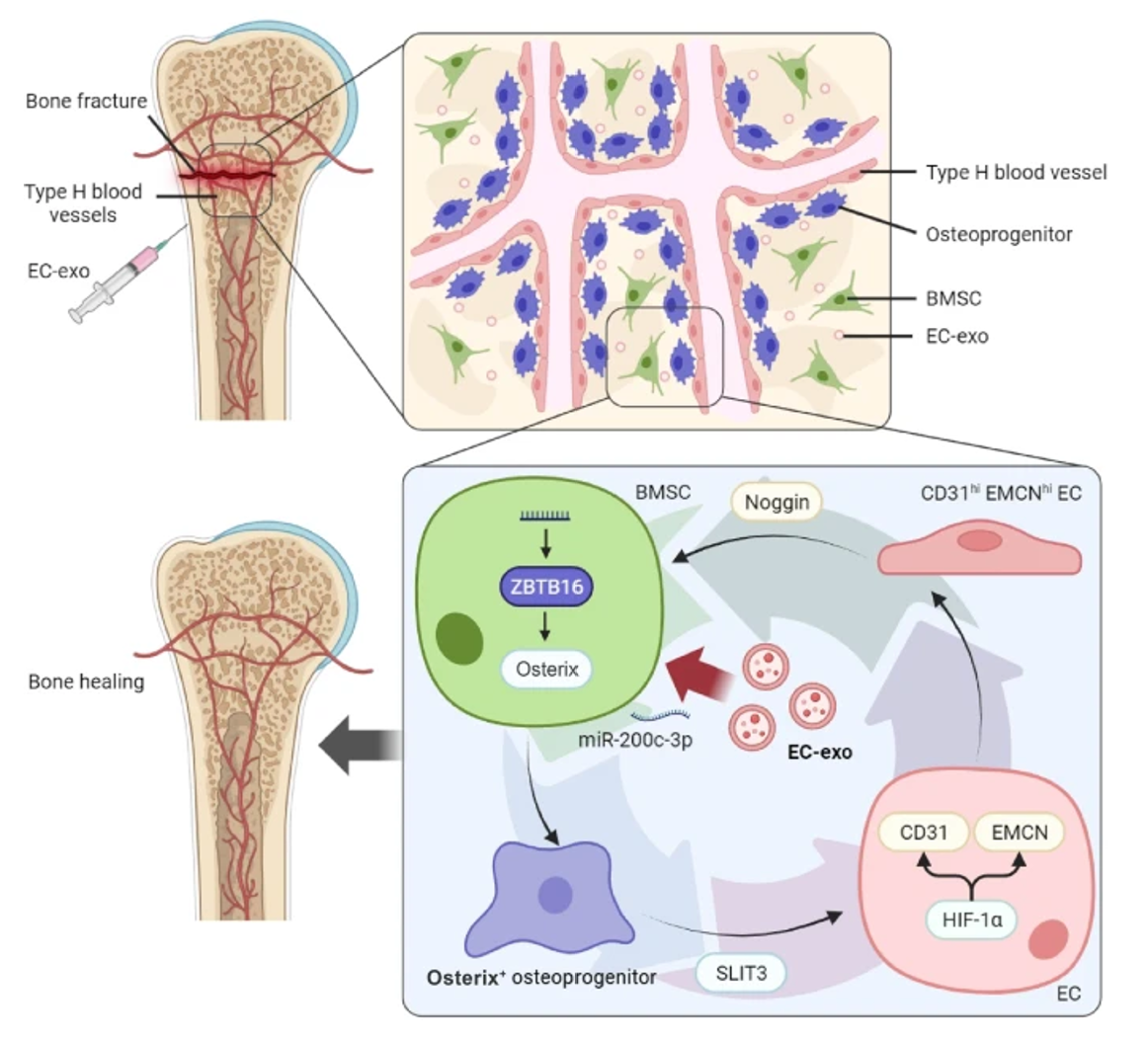
H型血管系统中成骨系细胞和内皮细胞之间的密切的时空联系被称为“成骨-成血管偶联”。内皮细胞(ECs)和骨髓间充质干细胞(BMSCs)以及他们的特异性谱系是参与骨微环境中成血管和成骨的关键细胞,在骨再生和发育过程中具有关键的调控作用。然而,在骨愈合条件下的“成骨-成血管偶联”的调控机制尚不十分明确。近期,吉林大学王元一教授团队在Journal of Nanobiotechnology杂志上发表题为“Endothelial cell-derived exosomes trigger a positive feedback loop in osteogenesis-angiogenesis coupling via up-regulating zinc finger and BTB domain containing 16 in bone marrow mesenchymal stem cell”的研究论文(2024 Nov 22:721)。该研究表明,ECs来源的外泌体(EC-exo)可触发的BMSCs和ECs之间的细胞串扰,从而构成一个增强“成骨-成血管偶联”的正反馈回路,同时验证了EC-exo有望成为促进骨修复的潜在治疗策略。文章的第一作者为刘璐,通讯作者为王元一、杨麒巍和王晓峰。
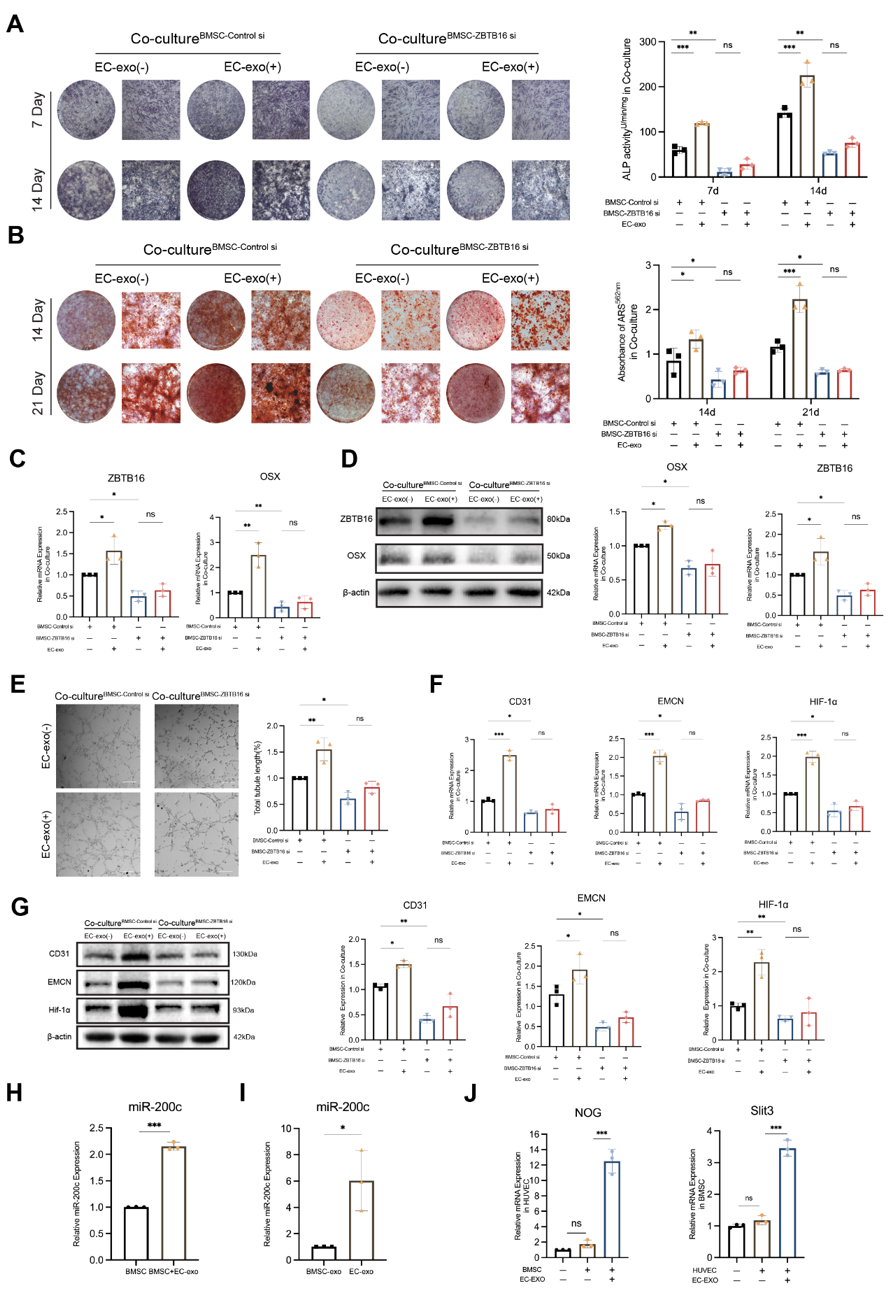
该团队证明了EC-exo是H型血管生成的启动因子,EC-exo可同时增强BMSCs成骨分化和ECs成血管的能力,并可在人原代细胞的单层和立体共培养系统中充当协调“成骨-成血管偶联”的媒介。转录组分析表明,ZBTB16是EC-exo介导成骨的关键基因;进一步细胞共培养模型验证表明,ZBTB16在EC-exo启动的“成骨-成血管偶联”中不可或缺。在机制研究中,该团队发现EC-exo上调BMSCs中ZBTB16基因的表达有利于成骨祖细胞表型转化并提高偶联因子Slit3的表达;Slit3则可通过激活HIF-1α通路进一步促进ECs转化为H型血管内皮细胞(H-ECs)并表达更多偶联因子Noggin,从而继续促进BMSCs的成骨分化。EC-exo触发的BMSCs和ECs之间的细胞串扰构成了一个增强“成骨-成血管偶联”的正反馈循环。这项研究表明,EC-exo有望成为促进骨组织再生和修复的潜在治疗策略。该研究还揭示了来自不同细胞的外泌体在骨组织修复过程中具有其独立的功能。EC-exo在“成骨-成血管偶联”方面具有MSC-exo所不具备的优势。成骨和成血管是一个基于细胞间串扰调控的复杂生理过程,需要一个启动因子来触发这一偶联形成机制上的正反馈回路,而ECs则通过分泌EC-exo精确地启动和放大这一过程,证明了ECs在组织再生中的关键作用和作为治疗靶点的研究潜力。图2 在EC-exo诱导的“成骨-成血管偶联”过程中BMSCs中的ZBTB16是不可或缺的Endothelial cell-derived exosomes trigger a positive feedback loop in osteogenesis-angiogenesis coupling via up-regulating zinc finger and BTB domain containing 16 in bone marrow mesenchymal stem cell. J Nanobiotechnol 22, 721 (2024). https://doi.org/10.1186/s12951-024-03002-5
外泌体资讯网 J Nanobiotechnol |吉林大学王元一/杨麒巍:EC-exo通过调节BMSCs触发“成骨-成血管偶联”正反馈循环