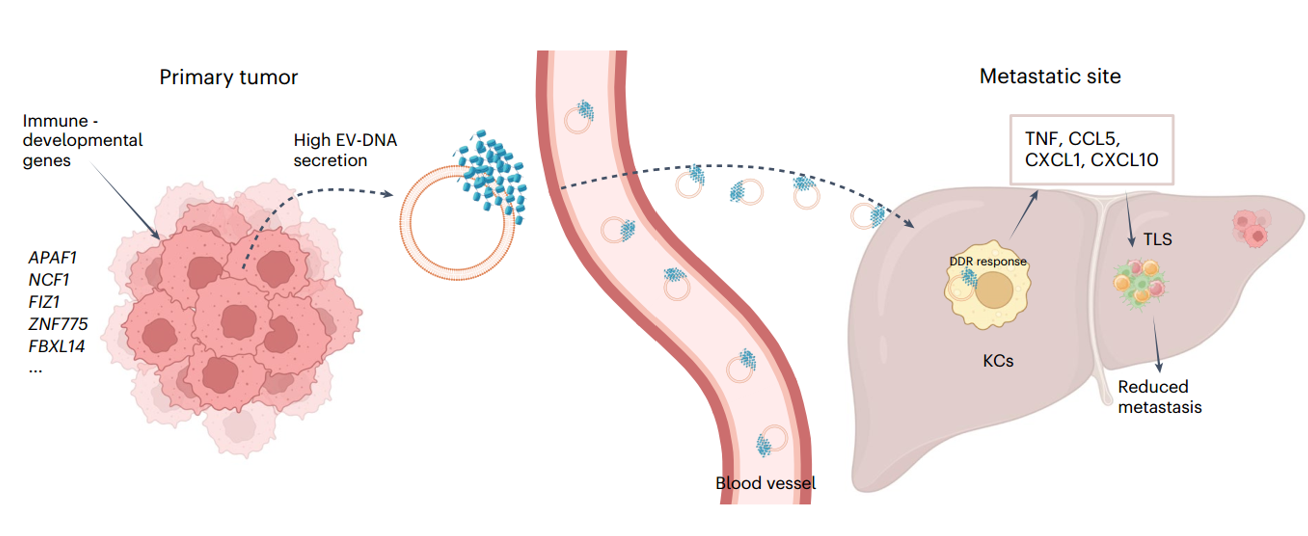
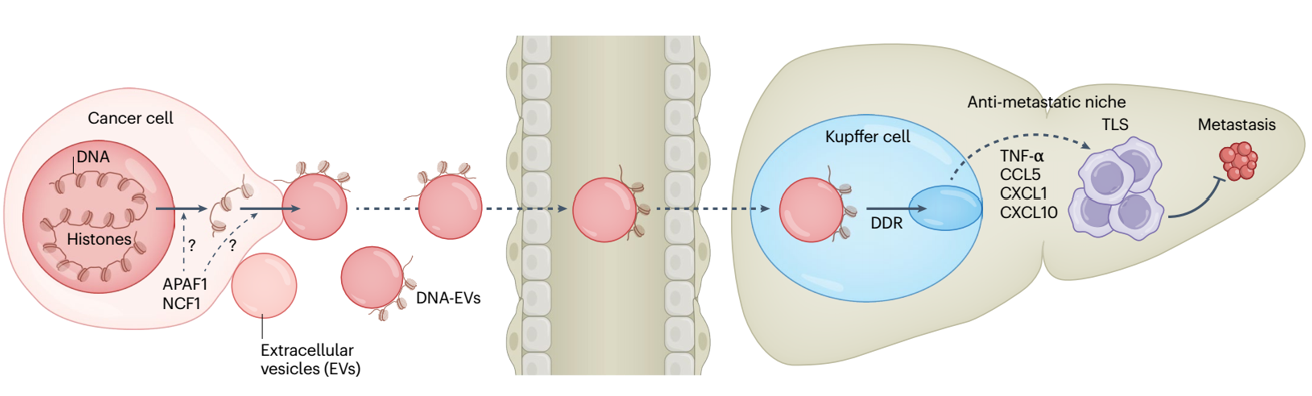
细胞外囊泡(EVs)运输介导细胞间通讯的生物分子。已经发现EVs中含有代表整个基因组的DNA(EV-DNA)。然而,基因组EV-DNA的包装机制及其在癌症中的作用仍不清楚。来自康奈尔大学Weill Cornell Medicine的David Lyden教授团队近日在Nature Cancer杂志上发表研究文章,报道了EV-DNA主要定位在囊泡表面,并与独特修饰和剪切的组蛋白相关联。此外,全基因组CRISPR敲除筛选揭示了免疫发育途径和基因,包括凋亡肽酶活化因子1(APAF1)和中性粒细胞胞浆因子1(NCF1),调节EV-DNA的包装。此外,在结直肠癌模型中,预转移肝脏Kupffer细胞(KCs)摄取EV-DNA激活了DNA损伤应答。这种激活重新调整了KCs的细胞因子产生,并促进了第三淋巴结结构的形成,从而抑制了肝转移。相反,APAF1的丧失减少了EV-DNA的包装并促进了肝转移。重要的是,结直肠癌活检中的EV-DNA分泌可以作为术后转移的预测生物标志物。总之,该研究的发现表明,独特的染色质化EV-DNA诱导了抗肿瘤免疫。
细胞外囊泡(EVs)是一种纳米级的运输系统,在生理和病理条件下由所有细胞分泌。EVs是异质的,并通过大小、起源和分泌方式进行分类。EV亚群有选择地包裹DNA、RNA、蛋白质和脂质等载体。这些囊泡参与了远距离细胞间的通讯,因为它们能够定位到远端器官并与特定细胞类型相互作用。作者研究团队和其他团队已经证明,癌细胞利用EVs促进肿瘤进展,通过对预转移微环境(PMN)的贡献,即一种促进循环癌细胞在远端器官定植的宽容微环境。已经确定了EV特异蛋白质和RNA对肿瘤进展和转移的贡献;然而,EV-DNA在转移过程中的作用仍不清楚。不同的EV-DNA检测方法产生了冲突的结果,表明EVs中含有不同数量的DNA。这种变异性是由于不同的EV分离策略或成像技术,还是因为来自不同来源的EV之间存在生物学差异,目前尚不清楚。然而,当检测到EV-DNA时,研究一致表明大部分(80%)位于囊泡表面。EV-DNA的大小范围在100 bp和10 kbp之间,主要来源于基因组DNA(gDNA),代表整个基因组,因此非常适合液体活检检测肿瘤特异性突变。EV-DNA被赋予了两个主要功能:通过双链DNA(dsDNA)识别途径激活免疫应答和进行水平基因转移。虽然只有少数研究表明EV介导的水平基因转移,但EV-DNA依赖的免疫应答激活已有大量文献支持。EV-DNA激活细胞DNA传感器,包括根据细胞内干扰素反应环状鸟苷酸单磷酸腺苷酸相互作用蛋白1(STING)或在黑色素瘤中缺失蛋白2(AIM2)信号通路的树突状细胞、单核细胞、巨噬细胞和小胶质细胞。基础研究表明,分泌EV-DNA对维持稳态至关重要,而无法分泌DNA会导致细胞溶质DNA积累,激活STING和产生活性氧自由基,导致衰老、细胞周期停滞或凋亡。此外,基因组不稳定性促进了微核的形成,微核随后与多囊体融合,将DNA载体装载到EVs上。尽管进行了大量EV生物发生学研究,但对EV-DNA的包装机制的了解仍然不足,而调控EV-DNA生物发生的基因和途径以及它们对癌症进展的影响尚未得到充分描述。EV-DNA预防转移的机制的示意图。APAF1和NCF1调节EV-DNA的包装,产生具有独特PTMs的染色质化DNA。到达肝脏的循环EV被KCs摄取,激活它们的DDR和细胞因子分泌。这种激活启动了TLSs的形成,增强了免疫监视并减少了转移潜力。该研究展示结直肠癌(CRC)和乳腺癌EV-DNA主要由基因组DNA(gDNA)组成,代表了整个基因组。该研究数据表明EV-DNA被组蛋白(EV-His)包裹,这些组蛋白在大小、变体和翻译后修饰(PTMs)方面与细胞内同源物有所不同。为了确定EV-DNA包装的遗传决定因素,作者进行了全基因组CRISPR敲除(KO)筛选,并确定了包括凋亡肽酶活化因子1(APAF1)和中性粒细胞胞浆因子1(NCF1)在内的免疫发育因子是EV-DNA包装的关键调节因子。研究还展示了EV-DNA在体内与转移潜能呈负相关。在CRC模型中,EV-DNA被Kupffer细胞(KCs)摄取,在预转移肝脏中激活了DNA损伤应答(DDR),并导致KCs产生抗肿瘤细胞因子。这种激活促进了肝脏中第三淋巴结结构(TLSs)的形成,随后介导抗肿瘤免疫反应,最终减少了肝转移的大小和数量。相比之下,APAF1的丧失减少了EV-DNA的包装和EV-His,显著促进了肝转移。携带基因组DNA的EVs通过重新编程免疫微环境抑制了肝转移。癌细胞系统性释放携带基因组DNA和组蛋白的EVs。这些携带DNA的EVs被肝脏的吞噬性库普弗细胞摄取,诱导DNA损伤修复,导致细胞因子和趋化因子的释放以及第三淋巴结结构(TLS)的形成,从而组织抑制癌症转移的免疫微环境。对CRC患者的活检分析显示,分泌的EV-DNA水平较高与肝脏、肺部、腹膜和远端淋巴结转移风险降低相关。总的来说,该发现确定了EV-DNA包装的关键调节因子,并揭示了肿瘤来源EV-DNA高水平如何修改PMN以激活抗肿瘤免疫并阻止转移进展的分子机制。Wortzel I, Seo Y, Akano I, Shaashua L, Tobias GC, Hebert J, Kim KA, Kim D, Dror S, Liu Y, Azrak GC, Cioffi M, Johnson KE, Hennika T, Twerski MZ, Kushner A, Math R, Han YD, Han DH, Jung M, Park J, Paik S, Shin JS, Lee MG, Russo MV, Zakheim D, Barnes J, Mehta S, Manova K, Schwartz RE, Thakur BK, Boudreau N, Matei I, Zhang H, Sidoli S, Bromberg J, David Y, Kim HS, Lyden D. Unique structural configuration of EV-DNA primes Kupffer cell-mediated antitumor immunity to prevent metastatic progression. Nat Cancer. 2024 Dec 3. doi: 10.1038/s43018-024-00862-6. PMID: 39627554.Rak J. Anti-metastatic extracellular vesicles carrying DNA. Nat Cancer. 2024 Dec 3. doi: 10.1038/s43018-024-00829-7. PMID: 39627553.外泌体资讯网 【Nature Cancer】EV-DNA促进抗肿瘤免疫抑制癌症转移进展