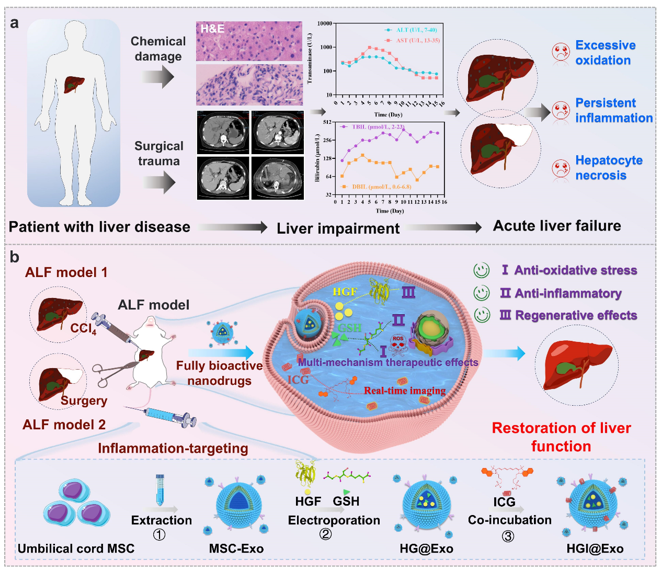
急性肝衰竭(ALF)是一种严重的全球性疾病,具有发病迅速和死亡率高的特点。目前,ALF的临床治疗面临着诸多挑战,主要由于药物选择有限以及肝脏移植资源稀缺。尽管诸如肝细胞生长因子(HGF)和谷胱甘肽(GSH)等生物大分子已在临床上用于缓解ALF症状,但仍面临稳定性差、难以作用于细胞内靶标以及治疗效果不佳等问题。近期,北京理工大学张金凤教授团队与暨南大学第一附属医院胡敏副研究员团队在ACS Nano杂志上发表题为“Fully Bioactive Nanodrugs: Stem Cell-Derived Exosomes Engineered with Biomacromolecules to Treat CCL4- and Extreme Hepatectomy- Induced Acute Liver Failure”的研究论文,该团队在其前期提出的全活性纳米药物(Full-API Nanodrug,FAND)新理念工作基础上(Jinfeng Zhang*,et al. Nat. Commun. 2023,14, 1660; Jinfeng Zhang*,et al. Adv. Funct. Mater. 2024, 34, 2401840; Weihong Tan*,et al. Nano Today. 2024, 57, 102399),充分利用间充质干细胞(MSC)固有的靶向性和再生能力,将MSC来源的外泌体(MSC-Exo)作为天然的生物活性载体,用于同时递送肝细胞生长因子(HGF)和谷胱甘肽(GSH),形成一种全生物活性的纳米药物,命名为HG@Exo。HG@Exo通过多种机制表现出强大的治疗效果,能够有效治疗四氯化碳(CCl4)和极量肝切除术诱导的ALF,包括调节氧化应激、减少炎症以及促进肝细胞再生。此外,研究团队还将FDA批准的近红外荧光染料吲哚菁绿(ICG)融合到外泌体中(HGI@Exo),赋予纳米药物实时体内示踪能力,提供了有关其生物分布和治疗效果的关键信息。总体而言,这项工作提出的具备靶向和多重治疗功能的全生物活性纳米药物不仅为治疗ALF及其他炎症性疾病提供了安全、可靠和有效的策略,还扩展了基于生物大分子或外泌体的治疗在临床转化中的应用。文章的共同第一作者为北京理工大学在读博士研究生孙梦及已毕业硕士研究生李敏,通讯作者为暨南大学第一附属医院胡敏,孙健及北京理工大学张金凤。
该团队结合临床肝病病人损伤的各项指标,证明了制备的HGI@Exo能够通过其固有的炎症定向能力靶向受损的肝脏,在CCL4和手术极量肝切除诱导的ALF小鼠体内表现促进肝细胞再生,抗炎和抗氧化应激的协同治疗作用。同时,HGI@Exo通过ICG荧光信号实现了综合监测和治疗,展现了全生物活性纳米药物的临床重要性。HGI@Exo具备固有的靶向性和多重治疗能力,提供了一种治疗ALF及其他炎症性疾病的前景策略。示意图1. 急性肝衰竭中HGI@Exo构建过程和高效治疗机制的示意图Fully Bioactive Nanodrugs: Stem Cell-Derived Exosomes Engineered with Biomacromolecules to Treat CCL4- and Extreme Hepatectomy-Induced Acute Liver Failure. ACS Nano. 2024. https://doi.org/10.1021/acsnano.4c07408.外泌体资讯网 ACS Nano|北京理工大学张金凤/暨南大学一附院胡敏:工程化干细胞衍生外泌体用于CCL4和极量肝切除术诱导的急性肝衰竭治疗