外泌体是细胞外囊泡(EVs)的一种,它们是由细胞膜内陷形成的多泡体(MVBs)释放到细胞外的纳米级小囊泡,它们在细胞间的通讯中起着至关重要的作用。在肿瘤微环境中,外泌体参与了肿瘤的生长、侵袭、转移以及免疫逃逸等多个过程,它能够携带肿瘤相关的抗原、蛋白质、脂质、mRNA和miRNA等生物分子,这些分子可以影响肿瘤细胞和周围环境的相互作用来调节免疫功能,同时外泌体作为药物递送系统具有多种优势,首先它们较高的生物相容性和低免疫原性减少了治疗过程中的副作用,其次外泌体的天然靶向性可以携带药物精确地到达肿瘤部位。
近日,北京化工大学谢文升/王兴/清华大学赵凌云在Small 上发表题为"Engineering Autologous Cell-Derived Exosomes to Boost Melanoma-Targeted Radio-Immunotherapy by Cascade cGAS-STING Pathway Activation"的论文(2024,Nov 27:e2408769)的研究论文。该文章表明,来源于肿瘤黑色素瘤的外泌体纳米激动剂MnExo@cGAMP具有自体靶向性能,能高效地在肿瘤细胞中积累,可以联合放疗级联激活cGAS-STING信号通路来阻断黑色素瘤免疫监视逃逸,并增强放疗治疗效果。文章第一作者为张方明、张紫瑶,通讯作者为谢文升、王兴、赵凌云。
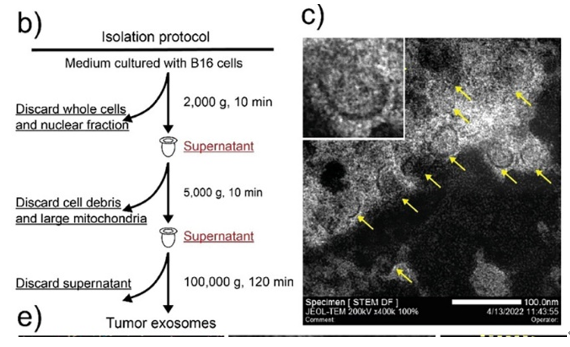
该团队利用梯度离心、超声、膜挤压法连续、批量地制备了大小均一的MnExo@cGAMP外泌体,并且利用HRTEM观察到外泌体典型的的磷脂双层膜结构,该结构揭示了超声处理后工程化自体外泌体的成功合成和完整的形态。
在机制研究中,该团队发现MnExo@cGAMP一旦被肿瘤细胞内化,释放的 Mn2+ 离子将增强干扰素基因刺激因子(STING)的结合,并使环 GMP-AMP (cGAS)对放疗诱导的双链 DNA(dsNDA)敏感,从而在 X 射线照射的同时放大 cGAS-STING 通路的激活。同时,负载的 2′,3′-cGAMP 可作为次级信使直接增强通路的活性。这些 cGAS-STING 通路的级联激活可引发 I 型干扰素的过度表达,促进树突状细胞(DCs)成熟、抗原递呈和 CD8+ T 细胞活化,从而克服黑色素瘤的免疫抑制,达到有效的放射免疫治疗效果。
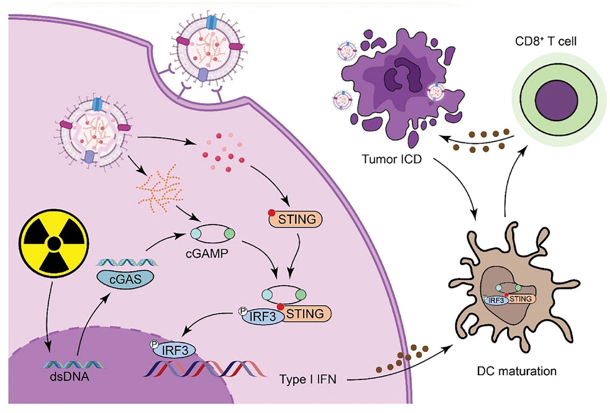
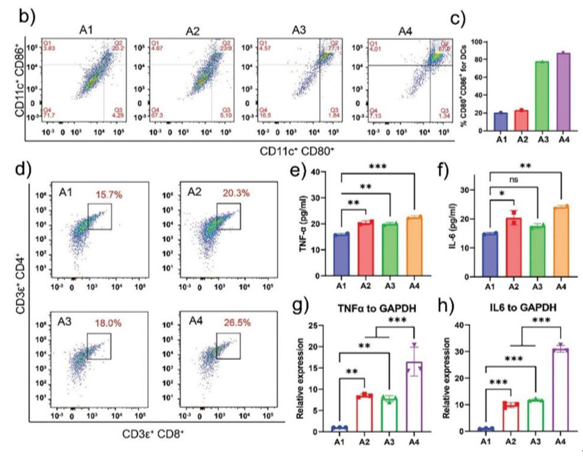
该研究还揭示了MnExo@cGAMP促进DCs细胞成熟、抗原递呈以及T细胞的活化,MnExo@cGAMP释放Mn2+离子将增加 cGAS 对肿瘤细胞的胞质 dsDNA 的敏感性,然后与2',3'-cGAMP 共同激活 cGAS-STING 通路以使DCs细胞成熟。
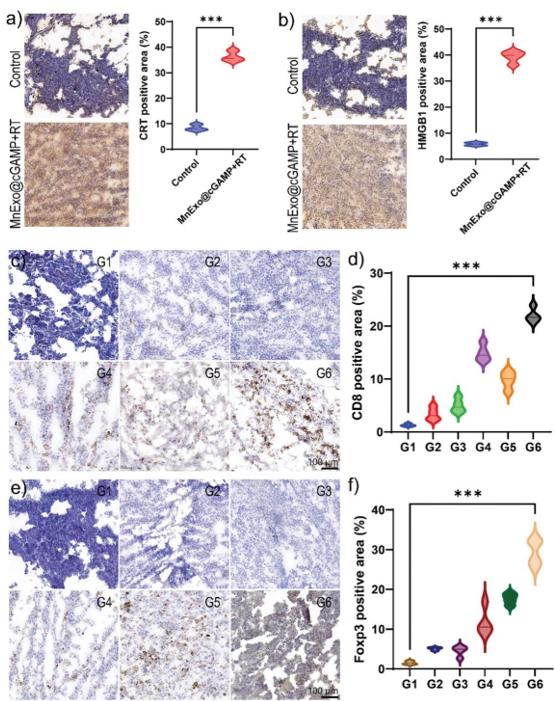
同时,MnExo@cGAMP联合放疗(RT)能显著促进CRT和HMGB1的释放,表明这种联合疗法对黑色素瘤具有免疫原性。此外,与其他组相比,MnExo@cGAMP联合低剂量X射线照射能增加肿瘤中细胞毒性T淋巴细胞(CTLs)的数量,显示出有效的免疫反应。同时,MnExo@cGAMP联合RT治疗还导致调节性T细胞(Foxp3+ CD4+ T细胞)数量增加,以维持治疗期间的免疫平衡,这证明了MnExo@cGAMP联合治疗极大地缓解黑色素瘤免疫抑制。
外泌体资讯网 Small | 北京化工大学谢文升/王兴/清华大学赵凌云:工程化自体外泌体纳米激动剂强化黑色素瘤放疗免疫治疗





