不同细胞来源的小型细胞外囊泡(sEV)已在心肌梗死(MI)的临床前模型中显示出改善心脏功能的效果。近日,阿斯利康(AstraZeneca)的研究人员在JEV杂志上发表文章,比较了不同细胞来源的sEV在心脏修复中的效果,并确定了最有效的来源。该研究全面评估了从hBM-MSC、hTERT-MSC、hESC、hESC-CPC、hESC-CM和hVCF六种细胞获取的sEV在体外模型中的作用,以及hTERT-MSC、hESC、hESC-CPC三种细胞源sEV的体内心脏修复模型中的效果,并初步探讨了修复机制。
心力衰竭是全球范围内导致疾病负担和死亡的主要原因,过去十年影响了超过6000万患者。尽管开发了多种可以改善心脏功能的药物和机械设备,但它们都未能促进已失去功能的心脏组织恢复为新的功能性心脏组织,这是引起心力衰竭的关键原因。在受伤后,心脏的内源性修复过程中已有心肌细胞的分裂有限。证据表明,心肌梗死(MI)后立即增强血管生成可以挽救心肌细胞免于死亡,并防止不良心脏重塑。此外,在哺乳动物的心脏中,心肌梗死后会丧失数百万心肌细胞,这些细胞会被纤维瘢痕组织所替代。因此,刺激治疗性血管生成、调控纤维瘢痕形成以及用新的心肌细胞替换受损组织被认为是促进心脏修复和防止心肌梗塞后发展为心力衰竭的关键过程。越来越多的证据表明,干细胞治疗可能是一种有前景的方法,用于形成新的功能性心脏细胞和改善血管生成。小型细胞外囊泡(sEV)已被确认为受伤后心脏中干细胞诱导效应的主要介质。sEV是直径小于200纳米的膜囊泡,由细胞分泌,携带膜蛋白和胞浆蛋白、代谢物以及包括mRNA、微RNA(miRNA)和长链非编码RNA(lncRNA)在内的核酸,这些都可以转移到接受细胞中并触发下游功能。先前的研究表明,从多种细胞类型(如间充质干细胞(MSC)、胚胎干细胞(ESC)、诱导性多能干细胞(iPSC)、心球、心脏祖细胞(CPC)、源自心外膜的细胞(EDC)和心肌细胞(CM))分离的细胞外囊泡(EVs),通过心脏修复改善了心肌梗塞后的心脏功能。然而,发挥心脏修复功能的特定EVs组分尚未十分明确,且不同细胞来源的EVs在心脏修复中可能产生的各种效应之间的缺乏全面的比较。该研究旨在比较相关的sEV来源,并从心脏修复的角度确定最有效的来源。为了实现这一目标,研究人员全面评估了从原代人类骨髓间充质干细胞(BM-MSC)、通过异位表达人端粒酶逆转录酶永生化的人类MSC(hTERT-MSC)、人类ESC、ESC衍生的CPC和CM获取的sEV在心脏修复的关键过程中的效果。进一步在小鼠心肌缺血-再灌注损伤(IRI)模型中调查了三种最有前途的sEV候选物的组成和功能性。研究结果显示,ESC-sEV在减少心肌梗塞后的不良心脏重塑方面最为有效,通过减少纤维化和增加缺血心脏的血管生成。此外,通过应用RNA测序和蛋白质组学分析,对sEV进行了大规模的转录组和蛋白质组特征鉴定。这些数据揭示了sEV内含成分与体外和体内观察到的效应之间的关联。
从不同细胞分离的囊泡的特征。(a)用于sEV制备的不同细胞源的示意图。(b)柱状图显示通过流式细胞术测量的表达每种指示细胞类型特异性标记物的细胞百分比。(c)分离sEV的电镜图像。放大后的图像突出了详细的囊泡形态。比例尺:200nm。(d)使用NanoSight LM14c进行sEV尺寸分布分析。(e) Western blot分析指定sEV及其亲本细胞蛋白提取物中的ALIX、CALNEXIN、TSG101、CD63、CD9和CD81。每个样品在Western blot中加载5µg细胞总蛋白或sEV蛋白。(f)来自指定细胞源的条件培养基每mL sEV产率。(g)来自指定细胞来源的每个活细胞的sEV产量。体外实验中,hESC衍生的sEV(hESC-sEV)展示了最佳的促血管生成和抗纤维化效果。随后,在小鼠的心肌梗死再灌注损伤(IRI)模型中评估了体外表现最有前景的几种sEV的功能,并分析了它们的RNA和蛋白质组成。在体内,hESC-sEV通过降低纤维化和增加血管生成,提供了最佳的结果,减少了不良的心脏重塑。此外,对来自hTERT-MSC、hESC和CPC的sEV进行的转录组和蛋白质组特性分析揭示了ESC-sEV中可能发挥心肌修复作用的成分。总之,hESC-sEV作为一种无细胞治疗方法,在促进心肌梗死后的心脏修复中具有巨大的潜力。
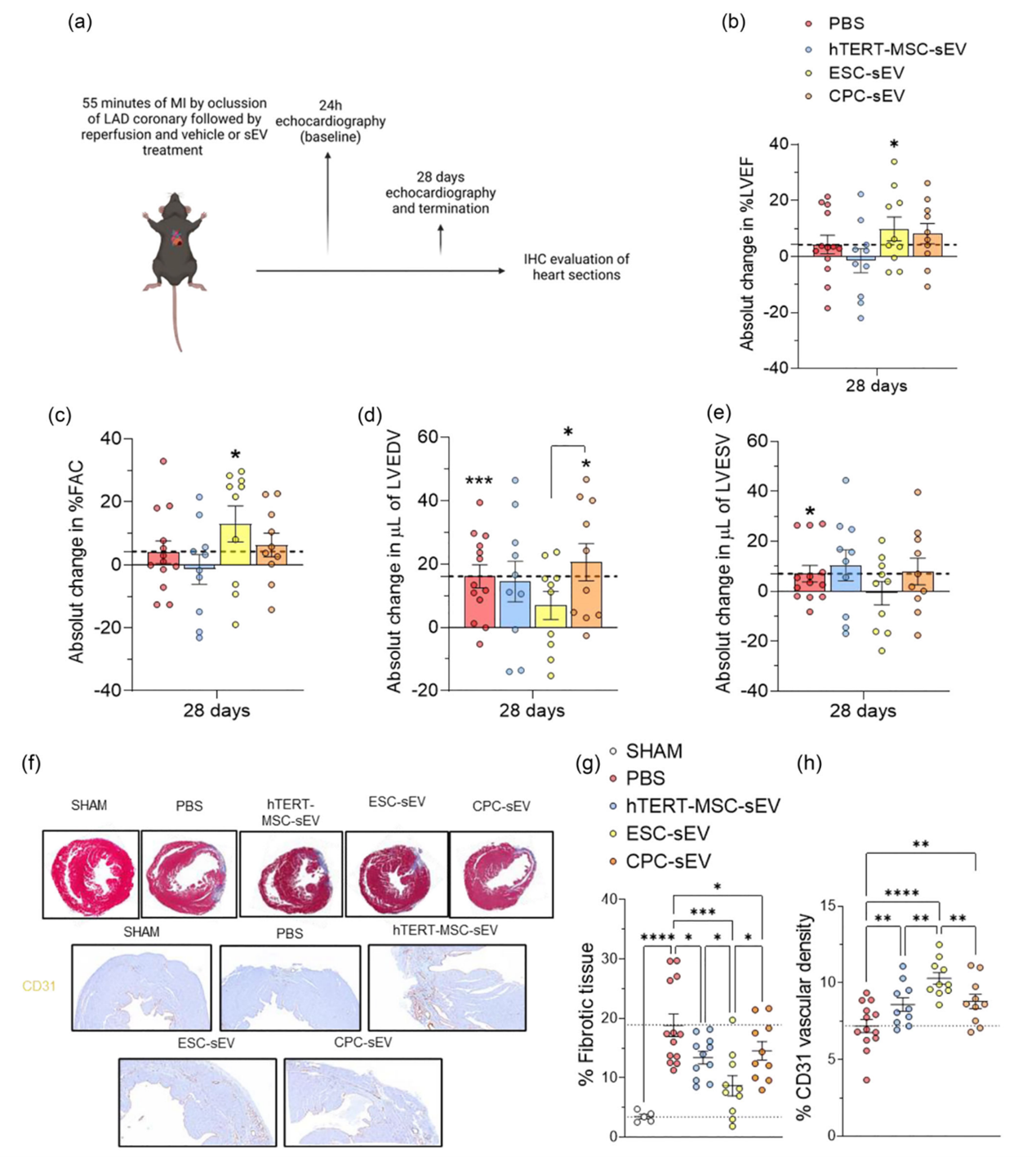
ESC-sEV可改善心功能,减少心肌缺血-再灌注损伤后的不良心脏重构。(a)心肌缺血再灌注损伤活体模型中sEV功能评估的实验设置示意图。(b-e)超声心动图数据显示心肌梗死和再灌注后28天与24小时(虚线)相比,LVEF (b,百分比)、FAC (c,百分比)、LVEDV (d,微升)和LVESV (e,微升)的绝对变化(虚线)。(f) 5个实验组(sham、PBS、hTERT-MSC-sEV、ESC-sEV和CPC-sEV)在M-IR后28天采集的心脏的马松三色(上一行)和抗cd31免疫染色(下两行)的代表性图像。(g, h)心脏切片纤维化组织百分比(g, F中蓝色染色)和血管密度百分比(h, F中棕色染色)。参考文献:González-King, H., et al. (2024). "Head-to-head comparison of relevant cell sources of small extracellular vesicles for cardiac repair: Superiority of embryonic stem cells." J Extracell Vesicles 13(5): e12445.






