细胞外囊泡(Extracellular vesicles, EVs)是一类由细胞主动释放的异质性纳米级膜结构颗粒。近年来,EVs因具有理化稳定性、良好的生物相容性、低免疫原性、可生物降解性和生物屏障可渗透性等优点,被视为一种卓越的天然药物递送和纳米治疗平台,被广泛应用于多种疾病的诊断和治疗。然而,在T细胞恶性血液病中,其应用尚未得到充分发掘。2024年12月16日,浙江大学基础医学院、浙江大学医学院附属第二医院蔡志坚课题组在国际胞外囊泡(International Society for Extracellular Vesicles, ISEV)官方期刊Journal of Extracellular Vesicles在线发表了题为“CD7-targeting pro-apoptotic extracellular vesicles: A novel approach for T-cell haematological malignancy therapy”的研究论文,该研究开发的αCD7/EVs/CytC/siBcl2对CD7+ T细胞恶性肿瘤表现出出色的靶向作用,在体内外均展现明显的抗肿瘤效果,并具有优异的安全性。
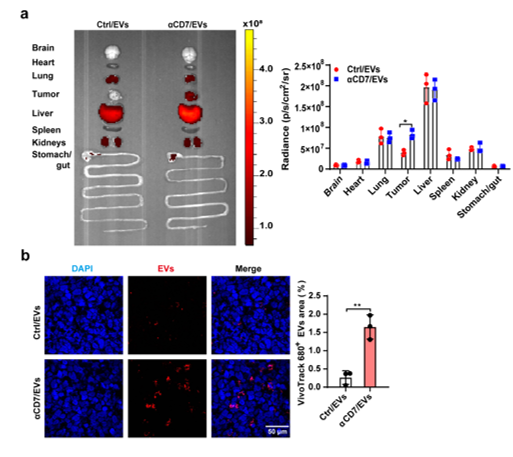
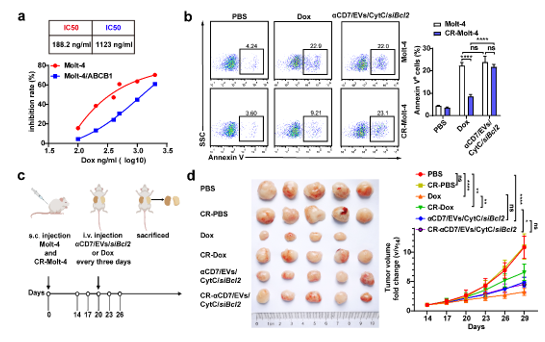
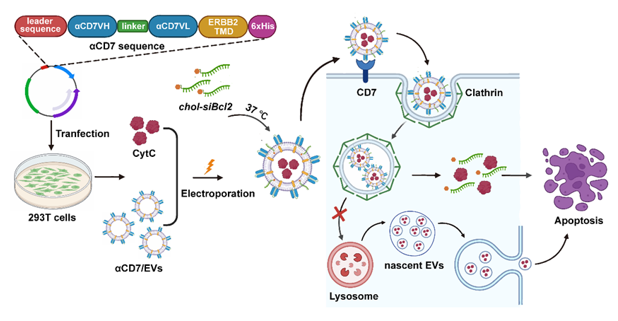
T细胞恶性肿瘤,是一类高度侵袭性和快速进展的肿瘤,发病率高,预后较差,其5年总生存率低于20 %。CD7是一种跨膜糖蛋白,在超过90%的T细胞恶性血液病中表达,使其成为治疗T细胞恶性肿瘤的一个新的免疫靶点。首先,该研究从CAR-T免疫疗法中汲取灵感,开发了一种抗CD7单链可变片段(anti-CD7 single-chain variable fragments, αCD7)表面修饰的293T细胞来源的EVs(αCD7/EVs)药物递送系统,发现αCD7修饰显著促进了EVs对CD7+人T细胞急性淋巴白血病细胞系Molt-4细胞的靶向性,这一现象在Molt-4小鼠肿瘤模型中也得到了充分验证(图1)。另外,αCD7修饰使EVs的内吞方式由巨胞饮依赖转变为网格蛋白依赖,随后通过观察EVs与内体系统的共定位,发现αCD7/EVs与Lamp1的共定位减少,提示网格蛋白介导的内吞作用更倾向于溶酶体逃逸,缓解药物溶酶体降解,从而提高药物的递送效率。其次,为了应对高剂量化疗药物导致T细胞恶性肿瘤产生耐药性的这一挑战,该研究通过电穿孔技术和共孵育的方式,将细胞色素C (CytC)和胆固醇修饰的Bcl2 siRNA (siBcl2)装载到αCD7/EVs内(αCD7/EVs/CytC/siBcl2)。研究结果证明,αCD7/EVs/CytC/siBcl2能显著诱导Molt-4细胞凋亡,并有效抑制了小鼠Molt-4皮下瘤和T-ALL肿瘤的生长。此外,本研究通过转染ABCB1慢病毒构建了化疗耐药的Molt-4细胞,并在体内外证实αCD7/EVs/CytC/siBcl2对CR-Molt-4的疗效优于化疗药阿霉素(图2)。图2 . αCD7/EVs/CytC/siBcl2抑制耐药的T细胞恶性肿瘤的生长最后,作者发现αCD7/EVs/CytC/siBcl2对小鼠的心、肝、脾、肺、肾等主要脏器及肝肾功能和健康志愿者外周血单核细胞来源的T细胞未造成不良影响,证实了其具有优异的生物安全性。αCD7/EVs/CytC/siBcl2治疗T细胞恶性肿瘤示意图综上所述,该研究开发的αCD7/EVs/CytC/siBcl2展现出色的靶向性、优异的治疗效果、高安全性和低免疫原性,是临床治疗CD7阳性T细胞恶性肿瘤的一种极具前景的治疗策略。浙江大学基础医学院博士研究生张贝、博士研究生陈建强、厦门医学院副教授陈际名和浙江大学邵逸夫医院特聘研究员沈颖颖为该论文的共同第一作者,浙江大学基础医学院蔡志坚教授为该研究的通讯作者。该研究受到国家重点研发计划和国家自然科学基金重点项目的资助。CD7-targeting pro-apoptotic extracellular vesicles: A novel approach for T-cell haematological malignancy therapy. J Extracell Vesicles, 2024 Dec;13(12):e70025. doi: 10.1002/jev2.70025.原文链接: https://doi.org/10.1002/jev2.70025外泌体资讯网 蔡志坚课题组在Journal of Extracellular Vesicles发文报道一种治疗T细胞血液瘤的创新方法