骨吸收与骨形成的动态平衡对于维持健康的骨稳态至关重要。核因子κB受体活化因子配体(RANKL)是骨吸收的主要激活因子。在绝经后妇女中,由于雌激素撤退,RANKL的表达增加。在这个时期,成骨作用与高度活跃的骨吸收失衡,导致骨质流失加速和骨质疏松。地舒单抗是一种RANKL的单克隆抗体抑制剂,已被证明能有效增加骨量。然而,停用地舒单抗会导致骨量迅速减少和椎骨骨折风险增加。此外,地舒单抗的全身给药与感染风险增加有关,以及股骨非典型骨折风险增加。间充质干细胞(MSCs)已显示出作为骨质疏松症潜在治疗方法的前景。EVs作为细胞间通讯的穿梭工具,将mRNAs、micro-RNAs和蛋白质等货物传递给受体细胞,以加速组织再生和愈合。
近日,苏州大学白进玉、周晓中、汪超、董启榕教授团队在ACS Nano杂志上发表题为“Receptor Activator of Nuclear Factor Kappa-B -Expressing Mesenchymal Stem Cells-Derived Extracellular Vesicles for Osteoporosis Therapy”的研究论文,主要介绍了表达核因子κB受体活化因子的基因工程化MSCs的EVs(EV@R)可以在骨质疏松小鼠模型中靶向递送至目标区域,EV@R上的RANK通过RANK-RANKL竞争性结合从而清除多余的RANKL,抑制破骨细胞分化和功能,改善骨质疏松症引起的骨质丢失。此外,EV@R中丰富的miRNA-21a-5p进一步促进成骨功能。
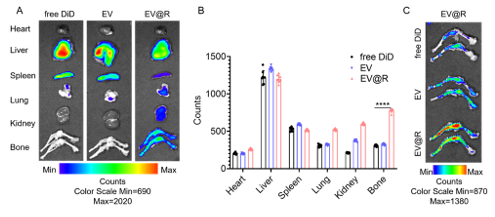
EV@R归巢至骨髓微环境
通过尾静脉注射了游离DiD、EV和EV@R。收集了肝脏、肾脏、脾脏、心脏、肺和骨组织以测试荧光强度。游离DiD在骨组织中的富集最低。相比之下,EV@R成功地归巢到骨髓,并显示出比正常EV更强的归巢能力。骨切片的免疫荧光显示DiD标记的EV@R成功地被招募到骨髓腔。间充质干细胞(MSCs)响应各种因素的趋化信号迁移到目标组织。CXCR4是MSC归巢和植入骨组织的关键介质。
图1EV@R通过抑制骨吸收和促进骨形成治疗骨质疏松症
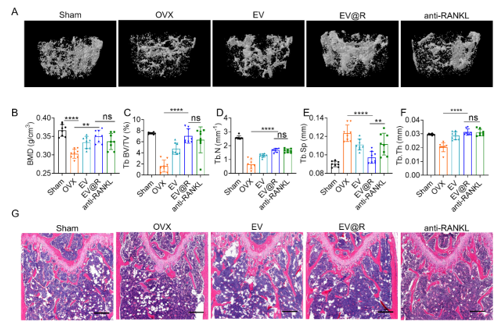
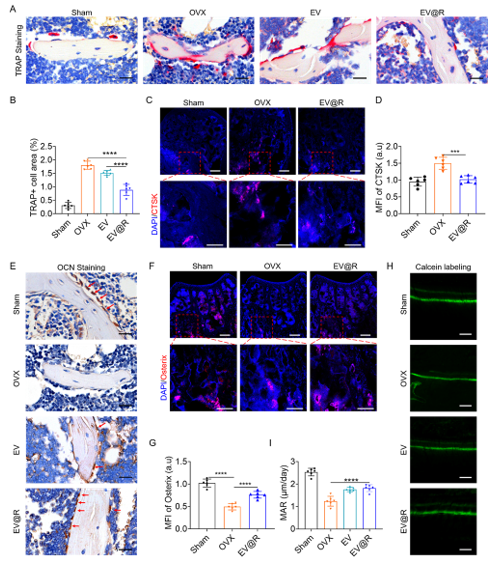
Micro-CT扫描的数据显示,EV@R给药的小鼠与其它组相比,保留了更多的松质骨。与OVX组相比,EV@R组的BMD、BV/TV、Tb.Th和Tb.N都增加,Tb.Sp值减少。骨组织H&E染色显示,EV@R和EV给药的OVX小鼠的骨组织中,白色脂肪细胞显著减少。与OVX组相比,EV@R和抗RANKL治疗组的松质骨形态和密度都得到了很好的保留。与OVX和EV组相比,EV@R治疗小鼠的骨表面TRAP阳性细胞区域减少,EV@R组的CTSK表达减少。双标钙黄绿素染色显示,与OVX小鼠相比,EV@R治疗的OVX小鼠的矿化附着率(MAR)显著更高。
图2 EV@R停药后,骨量得到一定程度的维持
由此可见,EV@R可从抑制破骨和促进成骨两个方面调节骨代谢,从而有效改善骨量,为骨质疏松症探索“里应外合、双管齐下”的治疗方案,具有良好临床转化前景。
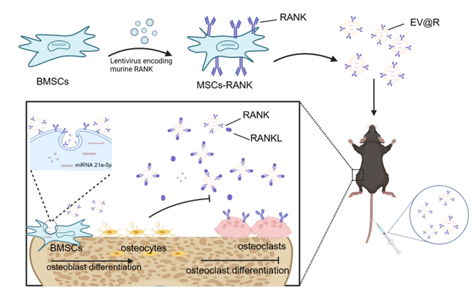
研究示意图
参考文献:
Receptor Activator of Nuclear Factor Kappa-B-Expressing Mesenchymal Stem Cells-Derived Extracellular Vesicles for Osteoporosis Therapy, ACS Nano. 2024 Dec 18. doi: 10.1021/acsnano.4c12064.
外泌体资讯网 ACS Nano|苏州大学白进玉/周晓中/汪超、董启榕:表达核因子κB受体激活因子的间充质干细胞来源的细胞外囊泡治疗骨质疏松症