胰腺癌是全球恶性程度最高的肿瘤之一,5年总生存率低于11%,预计到2030年将成为癌症相关死亡的第二大原因。由于胰腺癌起病隐匿且容易发生转移,在确诊时往往已错过最佳手术治疗时机。即使进行了手术切除,肿瘤复发和转移也是导致胰腺癌患者预后不良的原因之一。通常,肝脏转移占所有转移性胰腺癌病例的70%-80%,而肝转移的高发生率可归因于各种解剖和功能因素,包括异常的免疫微环境。
转移前生态位(PMN)的形成对癌症转移非常重要。PMN的形成主要是原发肿瘤通过信号分子(包括外泌体中的信号分子)与靶器官微环境中的细胞交流的产物,这些信号分子改变靶器官细胞的表型,促进肿瘤细胞的粘附和定植。
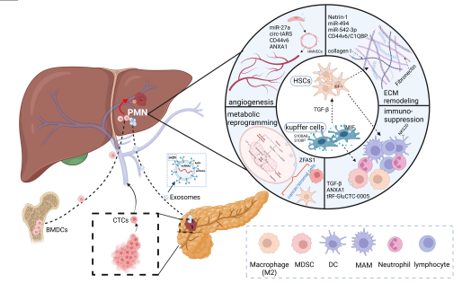
外泌体是一种膜结合的小囊泡,含有 DNA、mRNA、非编码 RNA、膜蛋白和代谢物等物质。肿瘤外泌体(TDEs)中的信号分子可通过细胞间信号转导重塑远处器官的微环境,促进 PMN 的形成,支持原发肿瘤转移和远处器官的定植。既往文献研究发现源自胰腺癌的外泌体蛋白,如迁移抑制因子(MIF)和 CD44V6/C1QBP复合物等均可促进肝脏 PMN 的形成,进而支持胰腺癌肝转移。因此,揭示TDEs在肝PMN形成中的作用非常重要。
近日,北京大学第一医院杨尹默、田孝东教授和国家纳米科学中心杨延莲研究员在Cancer Letters杂志上发表题为“Tumor-derived exosomes: unravelling the pathogenesis of pancreatic cancer with liver metastases and exploring the potential for clinical translation”的论文(2024 Dec 19:611:217403),主要介绍了TDEs通过支持血管生成和血管通透性、形成抑制性免疫微环境、重塑细胞外基质 (ECM) 以及参与调节代谢重编程等方面促进肝脏PMN形成,从而促进胰腺癌肝转移。
此外,文章还强调了早期检测和有效治疗胰腺癌肝转移的策略。第一作者为北京大学第一医院-李东奇,马永蔌和首都医科大学附属友谊医院-褚翔宇。通讯作者为北京大学第一医院杨尹默、田孝东教授和国家纳米科学中心杨延莲研究员。
在转移发生之前,骨髓衍生细胞(BMDCs)、TDEs、细胞因子和其他因素共同参与改变“土壤”,导致肿瘤血管生成、细胞成分组成、ECM、免疫环境和新陈代谢的改变,从而有利于转移性肿瘤的定植。而TDEs在参与胰腺癌转移的作用越来越显著,参与塑造PMN的形成和进展。
图 1. 胰腺癌外泌体促进肝脏预转移小生境(PMN)的形成。肿瘤衍生的外泌体通过促进血管生成和血管通透性、免疫抑制微环境的形成、细胞外基质重塑和代谢重编程来促进肝脏PMN的形成,从而导致胰腺癌肝转移。
鉴于胰腺癌转移(尤其是肝转移)的高发病率以及缺乏有效的诊断标志物,人们对胰腺癌TDEs进行了广泛的研究,以了解它们在诱导远处转移中的作用,TDEs被发现影响微环境之间的相互作用促进了胰腺癌的转移。此外,由于TDEs具有作为生物标记物、治疗靶点和递送系统的应用潜力,因此,在作为预测胰腺癌肝转移和新型治疗应用的诊断生物标记物具有巨大的潜力。
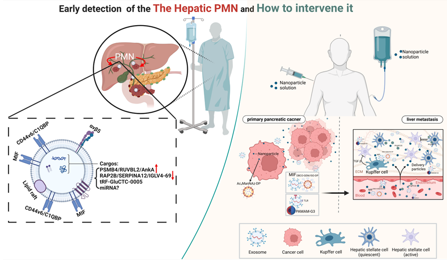
图 2. 肝转移前龛(PMN)的诊断和治疗。肿瘤外泌体有助于早期诊断肝脏 PMN,并通过开发新型纳米材料来抑制胰腺癌肝转移。参考文献:Tumor-derived exosomes: Unravelling the pathogenesis of pancreatic cancer with liver metastases and exploring the potential for clinical translation.Cancer Lett. December 19, 2024. doi: 10.1016/j.canlet.2024.217403.
外泌体资讯网 Cancer Lett|北京大学第一医院杨尹默/田孝东/国家纳米科学中心杨延莲:肿瘤外泌体揭示胰腺癌肝转移发病机制和临床转化潜力