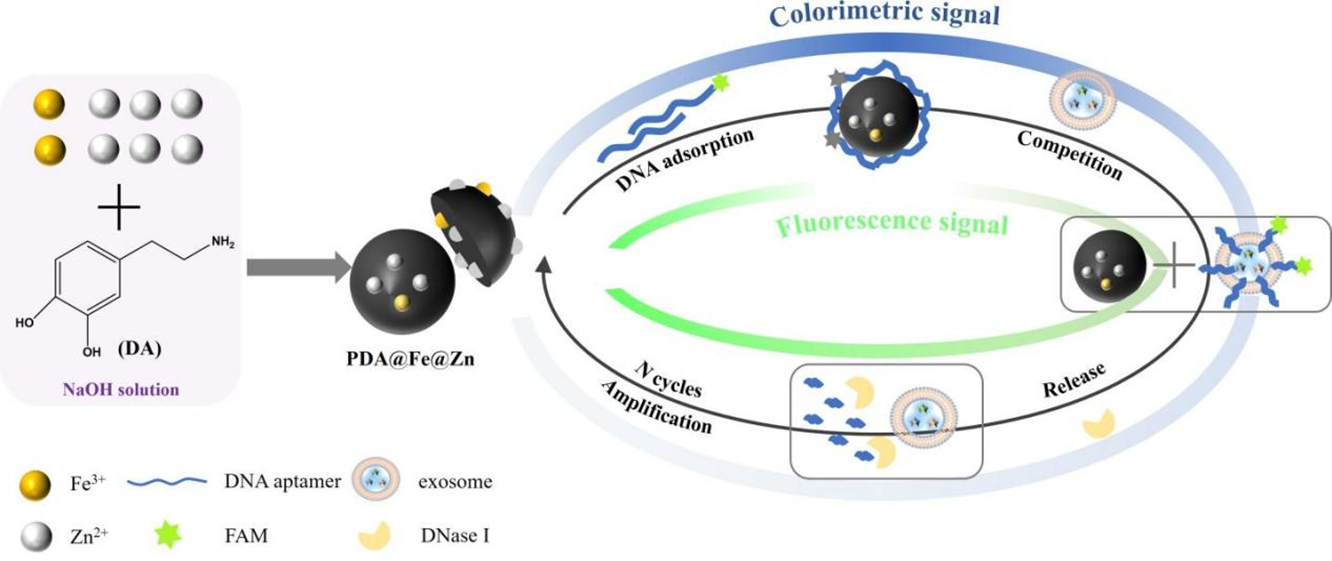
外泌体是细胞分泌的一种微小囊泡,携带核酸、蛋白质等生物分子,广泛参与细胞间通信,被认为是疾病诊断尤其是癌症诊断的重要标志物。然而,目前的检测方法(如酶联免疫吸附测定和纳米颗粒追踪分析)在灵敏度、操作复杂性等方面仍存在限制,亟需开发更快速、灵敏的检测技术。
近日,华东理工大学化学与分子工程学院胡坪团队在Talanta期刊上发表题为”Dual-mode exosome detection leveraging a nanozyme-active artificial receptor: PDA@Fe@Zn-based nucleic acid aptamer sensor”的研究论文(Talanta 2025;285:127380)。该研究开发了一种基于PDA@Fe@Zn的外泌体双模式检测平台,通过比色和荧光检测技术的结合,为外泌体的高灵敏度检测提供了一种创新的技术方案。赵凌浩和匡晶晶为论文的共同第一作者,胡坪教授和张敏副教授为共同通讯作者。
该研究基于PDA@Fe@Zn纳米材料,构建了一个同时支持比色和荧光检测的外泌体检测平台。PDA@Fe@Zn作为一种具有类过氧化物酶活性的纳米材料,在酸性条件下可催化TMB-H2O2反应生成显色信号,用于比色检测;同时,该材料能通过金属离子桥联作用吸附荧光标记的CD63核酸适配体,淬灭其荧光信号。引入外泌体后,CD63适配体优先与外泌体表面的靶标结合,从而脱附并恢复荧光信号,实现荧光“开关”检测。
基于PDA@Fe@Zn和DNase I实现的外泌体比色和荧光双重检测示意图
检测平台同时引入了DNase I酶切循环放大机制,选择性裂解结合外泌体的适配体,从而释放外泌体参与新一轮的反应循环。这种机制显著增强了比色和荧光检测的灵敏度。在优化条件下,比色检测的LOD为4.7 × 10⁴颗/mL,荧光检测的LOD为2.2 × 10⁴颗/mL,检测时间仅需30分钟,灵敏度和检测效率均优于传统方法。
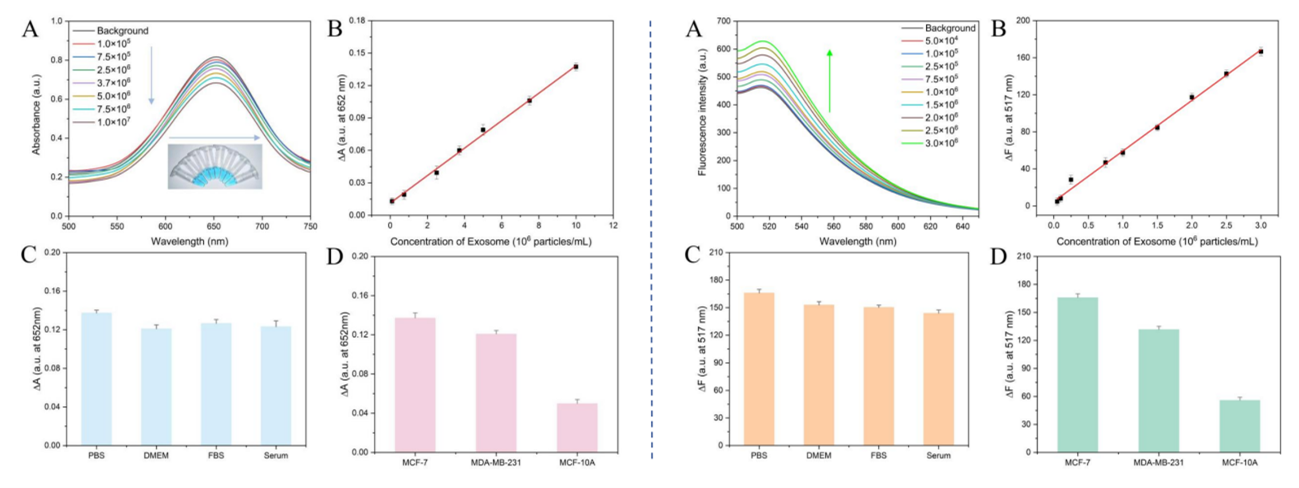
基于PDA@Fe@Zn纳米材料实现生物样本中外泌体的比色(左)和荧光(右)检测和区分
同时在血清、细胞培养基等复杂生物背景中,检测平台依然表现出高度的抗干扰能力,证明了其在真实样本中的适用性。实际样品的检测结果显示,该平台成功区分了乳腺癌细胞(MCF-7、MDA-MB-231)和正常乳腺细胞(MCF-10A)分泌的外泌体。癌细胞外泌体的CD63蛋白表达水平分别为正常细胞的2.7倍(比色平台)和2.4倍(荧光平台),双平台的检测结果相互印证,提高了方法的可靠性和准确性。这一双模式检测策略为外泌体在癌症诊断中的应用提供了全新的工具。
参考文献:
Dual-mode exosome detection leveraging a nanozyme-active artificial receptor: PDA@Fe@Zn-based nucleic acid aptamer sensor, Talanta 285 (2025) 127380
外泌体资讯网 Talanta|华东理工大学胡坪团队:利用具有纳米酶活性的人工受体实现外泌体的双模式检测:基于PDA@Fe@Zn的核酸适体传感器